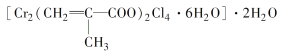-
铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1) Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3) Fe(CO)5的熔点为-20 ℃,沸点为103 ℃,易溶于乙醚,其晶体类型为______,
(4) 科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为______________________。
(5) FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρ g/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
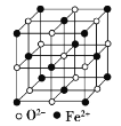
-
铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1)Fe2+的M层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有_______种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为_________。根据等电子原理,AlO2-的空间构型为____________。科学实验证明:通常状态下并不存在NaAlO2 , Al(OH)3溶于强碱溶液形成的阴离子,实际是因为Al(OH)3分子中铝原子最外层电子数未达到饱和 ,能与OH-离子形成配位键,Al(OH)3与碱反应时只能中和1molOH-,表现为一元酸,写出Al(OH)3表现酸性的电离的方程式______________;
(3)Fe(CO)5的熔点为-20℃,沸点为103℃,易溶于乙醚,在Fe(CO)5中铁的化合价为_______,在Fe(CO)5中σ键和π键的数目之比为______。
(4)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=_____。产生的蓝色沉淀的化学式____________。
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
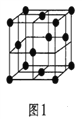
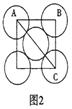
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。
-
硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼在元素周期表中的位置为_________,电子排布式是________,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为_______。
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式________________。
(3)与B一个周期的元素Be和C,它们的电离能由小到达的顺序 ____________________
-
过渡元素在生活、生产和科技等方面有广泛的用途。
(1)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是________(填序号)。
A.PFS中铁显+2价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| | Mn | Fe |
| 电离能 | I1 | 717 | 759 |
| (kJ·mol-1) | I2 | 1 509 | 1 561 |
| I3 | 3 248 | 2 957 |
(2)PFS中SO42-采取__________杂化,空间构型是_________。
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬与甲基丙烯酸根的配合物为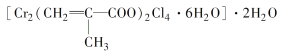
①该化合物中铬的化合价为___________。
②该化合物中一个Cr的配位数为________。
③甲基丙烯酸分子中C原子的杂化方式有___________________________________。
(4)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
| 化学式 | 键长/nm | 键角 |
| H2O | 0.99 | 104.5° |
| H2S | 1.34 | 92.3° |
| H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为__________________________________________________
-
第四周期的元素镓(Ga)、锗(Ge).、砷(As)、硒(Se)都在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为______________________。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是_____________________。
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为___________________,As原子采取_____________杂化。
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________________________。
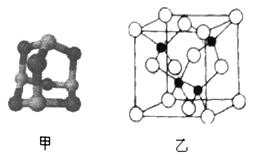
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为__________________________;砷化镓的晶胞结构如图乙所示,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
-
第四周期的元素镓(Ga)、锗(Ge).、砷(As)、硒(Se)都在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为______________________。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是_____________________。
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为___________________,As原子采取_____________杂化。
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________________________。
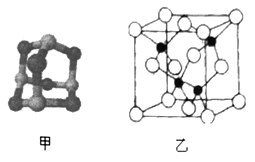
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为__________________________;砷化镓的晶胞结构如图乙所示,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
-
由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子排布式为____,P、S、Cl的第一电离能由大到小顺序为____。
(2)SCl2分子中的中心原子杂化轨道类型是____,该分子构型为_____。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为____;以“—”表示σ键、“→”表示配位键,写出Ni(CO)4分子的结构式____。
(4)已知MgO与NiO的晶体结构(如图)相同,其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是____。
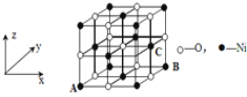
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为____。
(6)金刚石晶胞含有___个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(请用r和a表示不要求计算结果)。

-
由Mg、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)基态Mg原子L层电子排布式为_____,P、S、Cl的第一电离能由大到小顺序为_______。
(2)PH4Cl的电子式为_________,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为__________。
(3)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69 pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_____________。
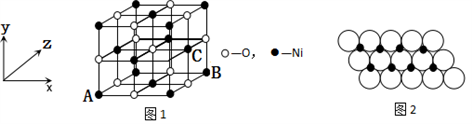
(5)如图1所示,NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),则C离子坐标参数为___________。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)
-
由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子排布式为__________________________,P、S、Cl的第一电离能由大到小顺序为____________________,P、S、Cl的电负性由大到小顺序为_______________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子构型为__________。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为_______;以“—”表示σ键、“→”表示配位键,写出CO分子的结构式__________。
(4)已知MgO与NiO的晶体结构(如图1)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_______________________________。

(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______。
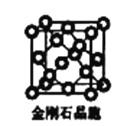
(6)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(请用r和a表示不要求计算结果)。