-
某铜合金中Cu的质量分数为80%~90%,还含有Fe等。通常用间接碘量法测定其中Cu的含量,步骤如下:
Ⅰ.称取a g样品,加入稀H2SO4和H2O2溶液使其溶解,煮沸除去过量的H2O2,冷却后过滤,滤液定容于250 mL容量瓶中;
Ⅱ.取50.00 mL滤液于锥形瓶中,加入NH4F溶液,控制溶液pH为3~4,充分反应后,加入过量KI溶液,生成白色沉淀,溶液呈棕黄色;
Ⅲ.向Ⅱ的锥形瓶中加入c mol·L−1 Na2S2O3溶液滴定,至锥形瓶中溶液为浅黄色时,加入少量淀粉溶液,继续滴至浅蓝色,再加入KSCN溶液,剧烈振荡后滴至终点;
Ⅳ.平行测定三次,消耗Na2S2O3溶液的体积平均为v mL,计算铜的质量分数。
已知:ⅰ.F−与Fe3+生成稳定的FeF63−(无色)。
ⅱ.I2在水中溶解度小,易挥发。
ⅲ.I2+I− ⇌ I3−(棕黄色)。
ⅳ.I2+2Na2S2O3== 2NaI+Na2S4O6(无色)。
(1)Ⅰ中Cu溶解的离子方程式是__________________________。
(2)Ⅱ中Cu2+和I−反应生成CuI白色沉淀和I2。
①加入NH4F溶液的目的是__________________________。
②Cu2+和I−反应的离子方程式是_________________________。
③加入过量KI溶液的作用是________________________________。
(3)室温时,CuSCN的溶解度比CuI小。CuI沉淀表面易吸附I2和I3−,使测定结果不准确。Ⅲ中,在滴定至终点前加入KSCN溶液的原因是_。
(4)样品中Cu的质量分数为______(列出表达式)。
高三化学实验题中等难度题查看答案及解析
-
天然石灰石是工业生产中重要的原材料之一,它的主要成分是 CaCO3,一般以CaO 的质量分数表示钙含量,常采用高锰酸钾法测定。步骤如下:
Ⅰ.称取 a g 研细的石灰石样品于 250 mL 烧杯中,加过量稀盐酸溶解,水浴加热 10 分钟;
Ⅱ.稍冷后逐滴加入氨水至溶液 pH≈4,再缓慢加入适量(NH4)2C2O4 溶液,继续水浴加热30 分钟;
Ⅲ.冷却至室温后过滤出沉淀,用另外配制的稀(NH4)2C2O4 溶液洗涤沉淀三次,再用蒸馏水洗涤至洗涤液中无法检出 Cl−;
Ⅳ.加入适量热的稀硫酸至沉淀中,获得的溶液用 c mol·L−1 KMnO4 标准溶液滴定至终点。
Ⅴ.平行测定三次,消耗KMnO4 溶液的体积平均为 V mL。
已知:H2C2O4 是弱酸;CaC2O4 是难溶于水的白色沉淀。
⑴Ⅰ中为了加快反应速率而采取的操作有_____。
⑵Ⅱ中加入氨水调节溶液 pH 的作用是_____。
⑶Ⅲ中洗涤得到干净的沉淀。
①结合平衡移动原理,解释用稀(NH4)2C2O4 溶液洗涤沉淀的目的__________________________。
②检测洗涤液中无 Cl−的试剂和现象是__________________________。
③若沉淀中的 Cl−未洗涤干净,则最终测量结果_____(填“偏大”、“偏小”或“不变”)。
⑷Ⅳ中用 KMnO4 标准溶液滴定。
①滴定时发生反应的离子方程式为_____。
②滴定至终点的现象为_____。
③样品中以CaO 质量分数表示的钙含量为_____(列出表达式)。
高三化学实验题简单题查看答案及解析
-
间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与 I-作用定量析出 I2;I2溶于过量的KI溶液中:I2+I-═I3-;且在溶液中:Fe3++6F-=[FeF6]3-( 六氟合铁(III)络离子 )
又知:微粒的氧化性强弱顺序为:Fe3+>Cu2+>I2>FeF63-
析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-═S4O62-+3I-.
现准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液.
(1)实验中,在加KI前需加入少量NaF,推测其作用可能是______;
(2)实验中加入稀硫酸,你认为硫酸的作用是______;
(3)本实验中用碘量瓶而不用普通锥形瓶是因为______;
(4)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:______;
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=______%.高三化学解答题中等难度题查看答案及解析
-
测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800毫升烧杯、100毫升量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100毫升)
(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800毫升烧杯底部,把短颈漏斗倒扣在样品上面。
②_______________________________________
③_______________________________________
④_______________________________________
(2)合金样品用铜网包裹的目的是:_______________________________________
高三化学实验题简单题查看答案及解析
-
某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品a g,称取时使用的仪器名称为 。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有 ;滤渣中含有 ;在溶解过滤时使用的主要玻璃仪器有 。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的化学方程式 。
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至重量不再减少为止,冷却后称量,质量为b g。有关反应的化学方程式为 。
(5)该样品中铝的质量分数的表达式为 。
高三化学填空题中等难度题查看答案及解析
-
某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验过程(实验前已经将合金样品磨成粉末状)
(1)称取样品ag,所用称量仪器使用的第一步操作为______.
(2)将上述样品溶解于足量稀盐酸中,过滤,滤渣中含有______.
(3)在滤液中加过量NaOH溶液,过滤.
(4)在第(3)步的滤液中通入足量的CO2,充分反应后过滤,将沉淀用蒸馏水洗涤数次后,烘干灼烧至质量不再减少为止.冷却后称量,质量为bg.有关反应的离子方程式为______ Al2O3+3H2O高三化学解答题中等难度题查看答案及解析
-
某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下方案检验:
(1)取样品a g,称取时使用的仪器名称为________。
(2)将样品溶于足量的稀盐酸中,过滤,滤液中主要含有________离子,滤渣中含有________,在溶解过滤时使用的仪器有________。
(3)在滤液中加入过量的氢氧化钠溶液,过滤,写出该步操作中有关反应的化学方程式为________________________________________
________________________________________。
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为b g。计算该样品中铝的质量分数________。
高三化学填空题简单题查看答案及解析
-
某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品ag,称量时应该使用的主要仪器的名称是________。
(2)将样品溶解于足量的稀盐酸,过滤。滤液中主要含有________,滤渣中含有________,溶解、过滤用到的玻璃仪器是________,如果这一实验在月球上完成,它比在地球上做要________(填“容易”或“难”)。
(3)滤液中加过量的氢氧化钠溶液,过滤,有关反应的离子方程式为________。
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤,有关反应的离子方程式为________。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称重,其质量为b g,原样品中铝的质量分数是________。
(6)若步骤(3)中加入氢氧化钠的量不足,则实验结果________(填“偏高”、“偏低”或“不影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果________,若滤渣灼烧不充分,则实验结果________。
高三化学实验题困难题查看答案及解析
-
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组设计如图所示的实验装置
夹持装置略
,采用碘量法测定学校周边河水中的溶解氧的含量。
实验步骤及测定原理如下:
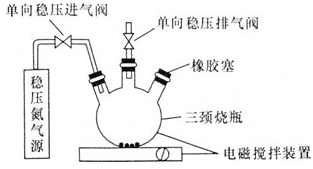
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度。
向烧瓶中加入200mL水样。
向烧瓶中依次迅速加入
无氧溶液
过量
和2mL碱性KI无氧溶液
过量
,开启搅拌器,反应生成
,实现氧的固定。
Ⅱ
酸化、滴定
搅拌,并向烧瓶中加入2mL硫酸无氧溶液至
被
还原为
,溶液为中性或弱酸性。
在暗处静置5min后,取一定量溶液,用
标准溶液滴定生成的
,记录数据。
处理数据
忽略氧气从水样中的逸出量和加入试剂后水样体积的变化
。
回答下列问题:
配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为________。
取水样时应尽量避免扰动水体表面,这样操作的主要目的是________。
“步骤c”中“搅拌”的作用是________。
“氧的固定”中发生主要反应的化学方程式为________。
“步骤f”为________。
“步骤e”中,用amol/LNa2S2O3标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为________;若200mL水样经处理后,共消耗
标准溶液的体积为bmL,则水样中溶解氧的含量为________
用含字母的式子表示)mg/L。
“步骤d”中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因
用离子方程式表示,至少写出2个
:________。
高三化学实验题困难题查看答案及解析
-
铜及其化合物具有广泛的应用,间接碘量法可以测定铜合金中的铜,回答下列问题:
(1)铜合金的种类较多,主要有黄铜和各种青铜等。试样可以用HNO3分解,还需要用到浓H2SO4.CuSO4和Cu(NO3)2中阳离子的基态核外电子排布式为______;S、O、N三种元素的第一电离能由大到小的顺序为______;
(2)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2,其中NH3中心原子的杂化轨道类型为______,[Cu(NH3)4](NO3)2属于______晶体。
(3)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1 mol CN-中含有的π键数目为______,与CN-互为等电子体的离子有______(写出一种即可);
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因可能是______;
(5)在弱酸性溶液中,Cu2+与过量KI作用,生成CuI沉淀,同时析出定量的I2;如图为碘晶体晶胞结构。下列有关说法中正确的是______;

A.碘分子的排列有2种不同的取向,2种取向不同的碘分子,以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
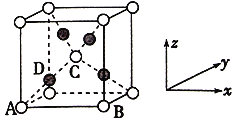
(6)已知Cu2O晶胞结构如图所示,该晶胞原子坐标参数A为(0,0,0),B为(1,0,0),C为(
)。则D原子的坐标参致为______,它代表______原子(填元素符号);已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是12,Cu原子的空间利用率是______。
高三化学综合题困难题查看答案及解析