-
CuSO4 是一种重要化工原料,其制备和有关性质如图所示。
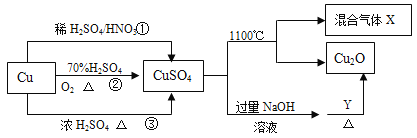
(1)现要用密度为 1.84g/mL,质量分数为 98%的浓硫酸来配制步骤①中所需要的 2mol/L 的稀硫酸480mL,需要用这种浓硫酸的体积为_____mL。
(2)配制该稀硫酸所用到的玻璃仪器除玻璃棒、量筒外还有_____。
(3)下列操作会使所配溶液浓度偏高的是_____。
A. 硫酸转移至容量瓶后,没有洗涤烧杯
B. 未冷却至室温就转移至容量瓶
C. 容量瓶中存在少量蒸馏水
D. 定容时俯视刻度
E. 用量筒量取浓硫酸后洗涤量筒
(4)制取硫酸铜的途径①②③中,不用_____途径,原因是_____。
-
硫酸是重要的基础化工原料之一,是化学工业中最重要的产品,号称“工业之母”。在中学化学教材中有多处涉及其应用。
(1)利用浓硫酸配制稀硫酸
已知某浓硫酸的密度为1.84g/ml,质量分数为98%,则该浓硫酸的物质的量浓度为_______;
现用该浓硫酸配制480ml浓度为1.84mol/L的稀硫酸,在配制过程中除量取浓硫酸的仪器、烧杯、胶头滴管外,还需用到的玻璃仪器有______________________;
(2)硫酸与无机物的反应
实验室在用稀硫酸与锌反应制取氢气时,常向其中滴加少量硫酸铜溶液以加快反应速率,请写出发生的离子反应方程式______________________________;不活泼金属铜在与浓硫酸反应中,体现了浓硫酸的___________________性质;非金属碳在加热条件下也能与浓硫酸反应,若要你设计实验检验反应生成的气体产物,则检验出气体产物的正确顺序为______________________;
(3)硫酸在有机中的应用
利用硫酸的性质可以制取多种有机物,比如烈性炸药TNT、硝基化合物、酯类物质、不饱和烃等。请写出制取TNT的化学方程式________________________________________;请写出用乙醇制取乙烯的化学方程式________________________________________;稀硫酸还可以使蔗糖、淀粉等多种有机物发生水解,请写出蔗糖水解的产物名称_________。
-
某同学用质量分数为98%、密度为1.84 g/cm3的浓硫酸,配制100 mL 2 mol/L H2SO4溶液,并进行有关的实验。试回答下列问题:
(1)计算所需浓硫酸的体积。
(2)从下列仪器中选出实验所需要的仪器________(填序号)。
A.10 mL量筒 B.20 mL量筒 C.100 mL烧杯 D.100 mL容量瓶
E.托盘天平 F.分液漏斗 G.玻璃棒 I.胶头滴管
(3)该同学为测定某碳酸钠样品的纯度,取2.5 g该碳酸钠样品,加入足量上述稀硫酸。碳酸钠完全反应(杂质不反应),生成二氧化碳气体448mL(标准状况)。求该碳酸钠样品中Na2CO3的质量分数。
-
浓H2SO4 密度1.84g/mL,物质的量浓度为18.4 mol/L , 质量分数为98% ,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%。下列组合正确的是( )
(1).若b=49 则a=18.4 C>9.2 (2) 若b=49 则a=18.4 C<9.2
(3).若C=9.2 则a>10 b>49 (4) 若C=9.2 则a>10 b<49
A.(1) (3) B.(1) (4) C.(2) (3) D.(2) (4)
-
浓H2SO4 密度1.84g/mL,物质的量浓度为18.4mol/L,质量分数为98%,取10mL浓H2SO4和a mL水混合得物质的量浓度为C mol/L,质量分数为b%.下列组合正确的是( )
(1)若C=9.2则a>10 b>49%
(2)若C=9.2则a>10 b<49%
(3)若b=49则a=18.4 C<9.2
(4)若b=49则a=18.4 C>9.2.
A.(1)(3) B.(1)(4) C.(2)(3) D.(2)(4)
-
浓H2SO4 密度1.84g/mL,物质的量浓度为18.4mol/L,质量分数为98%,取10mL浓H2SO4和a mL水混合得物质的量浓度为C mol/L,质量分数为b%.下列组合正确的是( )
(1)若C=9.2则a>10 b>49%
(2)若C=9.2则a>10 b<49%
(3)若b=49则a=18.4 C<9.2
(4)若b=49则a=18.4 C>9.2.
A.(1)(3) B.(1)(4) C.(2)(3) D.(2)(4)
-
浓H2SO4 密度1.84g/mL,物质的量浓度为18.4 mol/L , 质量分数为98% ,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%。下列组合正确的是
(1)若C=9.2则a>10 b>49%
(2)若C=9.2则a>10 b<49%
(3)若b=49则a=18.4 C<9.2
(4)若b=49则a=18.4 C>9.2
A.(1) (3) B.(1) (4) C.(2) (3) D.(2) (4)
-
浓H2SO4 密度1.84g/mL,物质的量浓度为18.4 mol/L , 质量分数为98% ,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%。下列组合正确的是
(1).若C=9.2则a>10 b>49% (2) 若C=9.2则a>10 b<49%
(3).若b=49则a=18.4 C<9.2 (4) 若b=49则a=18.4 C>9.2
A.(1) (3) B.(1) (4) C.(2) (3) D.(2) (4)
-
质量分数98%的浓H2SO4密度为1.84g/mL,物质的量浓度为18.4moL/L,取10mL该浓H2SO4和a mL水(密度为1.0g/mL)混合后所得硫酸溶液中溶质的物质的量浓度为c moL/L,质量分数为b%。下列有关组合正确的是( )
⑴若 b=49 则 a=18.4 c>9.2
(2)若b=49 则 a=18.4 c<9.2
(3)若 c=9.2,则 a>10 b>49%
(4)若 c=9.2 则 a>10 b<49%
A.⑴(3) B.⑴(4) C.(2)(3) D.(2)(4)
-
将密度为1.84 g / cm3、质量分数为98%的浓硫酸稀释成1 000 mL、物质的量浓度为2 mol /L、密度为1.20 g / cm3的稀硫酸。求:
(1)所需浓硫酸的体积;
(2)所需水的体积。
