-
化学小组通过下列步骤测定某工厂废液中铜离子的浓度(已知废水中Fe3+对测定有干扰作用)。
i. 经检验废液中含有Fe3+离子,取V1 mL上述废液,加入NH4HF2,再加H2SO4酸化至pH<4,再次检测,未检验出Fe3+离子;
ii. 在上述溶液中,加入过量KI溶液,放置3 min,有沉淀CuI生成,立即用0.1000 mol/LNa2S2O3标准溶液滴定至浅黄色,加3 mL淀粉指示剂,继续滴定,至溶液变为浅蓝色;
iii. 再向上述溶液中加入10% KSCN溶液10 mL,继续滴定至终点,共消耗Na2S2O3溶液V2 mL。
已知:①CuI、CuSCN均为白色难溶物,CuI能吸附少量I2,CuSCN不吸附I2。
②I2在水溶液中溶解度较小,I-+I2 I3-、I-、I2、I3-的平衡体系溶液呈黄色
I3-、I-、I2、I3-的平衡体系溶液呈黄色
③I2+2S2O32-=2I-+S4O62-,S2O32-和S4O62-无色;
(1)①步骤i中检验含Fe3+离子操作和现象_______。
②已知 Fe3++6F- [FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
[FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
(2)①步骤ii中生成沉淀的离子方程式_____________。
②步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+充分反应;二是__________。
(3)①步骤iii中加入KSCN溶液使ii中的沉淀转化为CuSCN沉淀,其目的是___________。
②步骤iii中判定滴定终点的现象是_____________。
(4)经小组测定,废液中c(Cu2+)=______________。
-
为防止环境污染和发生意外事故,实验过程中产生的废液不能随意倒入下水道。已知某次化学实验后,回收的废液中可能含有K+、Cu2+、Ag+等离子。
(1)为检验废水中是否含有Ag+,可以采用的试剂是 。如果溶液中确实存在Ag+,加入试剂后,将观察到的现象是________
。
(2)实验证明,废液中确实存在上述三种离子。为回收Cu、Ag两种金属,实验时可以分别加入过量的 和 (填物质名称),充分反应后,经过 (填实验操作名称),可得到Cu和Ag。经过上述处理后的废水,进一步处理后即可以排放。
-
某废液中含有Fe3+、Cu2+、Ag+金属离子,某研究小组设计的处理方案如下(假如各步骤所加试剂都过量):

(1)沉淀1的主要成分是_________(用元素符号表示),沉淀2化学式为___ ___。
(2)步骤②发生反应的离子方程式 。
-
某化学工厂产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等离子。综合利用该酸洗废液的工艺流程如下:
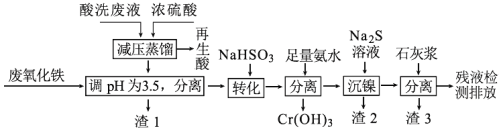
已知:①Ni2+与足量氨水的反应为:Ni2++6NH3  [Ni(NH3)6]2+
[Ni(NH3)6]2+
②金属离子开始沉淀和沉淀完全时的pH表③Ksp(CaF2)=4 10-11
10-11
| Fe3+ | Ni2+ | Cr3+ |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
回答下列问题:
(1)再生酸中主要含有硝酸,采取减压蒸馏的原因是_______________________
(2)渣1的主要成份为______(填化学式)
(3)转化时发生反应的离子方程式______________________________
(4)用平衡移动的原理解释沉镍的原理_____________________________
(5)渣3的主要成分为氢氧化钙和_______________ 、_________________(填化学式)
(6)国家排放标准要求c(F-)≤3.8 mg•L-1。残液中残留的Ca2+浓度至少应为_____mg•L-1
-
某化学实验室产生的废液中的阳离子只可能含有Na+、NH4+、Ba2+、Cu2+、Al3+、Fe2+、Fe3+中的某几种,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。
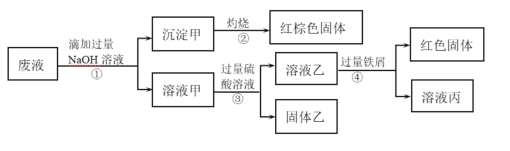
已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是
A.根据步骤①的现象,说明废液中一定含有Al3+
B.由步骤②中红棕色固体可知,废液中一定存在Fe3+
C.沉淀甲中可能含有Al(OH)3
D.该废液中一定含有NH4+、Ba2+、Cu2+、Fe2+和Fe3+至少存在一种
-
某化学实验室产生的废液中的阳离子只可能含有Na+、NH4+、Ba2+、Cu2+、Al3+、Fe2+、Fe3+中的某几种,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。

已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是
A.根据步骤①的现象,说明废液中一定含有Al3+
B.由步骤②中红棕色固体可知,废液中一定存在Fe3+
C.沉淀甲中可能含有Al(OH)3
D.该废液中一定含有NH4+、Ba2+、Cu2+、Fe2+和Fe3+至少存在一种
-
某实验室产生的废液中含有Fe3+、Cu2+、Ba2+三种金属离子,研究小组设计了下列方案对废液进行处理,以回收金属,保护环境。

请回答:
(1)步骤①②④用到的主要玻璃仪器是___________________。
(2)步骤③的实验现象是_________________。
(3) 设计一个实验方案,验证步骤①中所加硫酸溶液己经过量____________________。
-
某工厂废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。根据各物质的性质(如下表),确定通过下列步骤回收乙醇和乙酸。
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
①向废液中加入烧碱溶液,调整溶液的pH=10
②将混合液放入蒸馏器中缓缓加热
③收集温度在70~85℃时的馏出物
④排出蒸馏器中的残液。冷却后向其中加浓硫酸(过量),然后再放入耐酸蒸馏器进行蒸馏,回收馏出物
请回答下列问题:
(1)加入烧碱使溶液的pH=10的目的是___(用化学方程式表示)。
(2)在70~85℃时馏出物的主要成份是___。
(3)在步骤④中,加入过量浓硫酸的目的是___(用化学方程式表示)。
(4)当最后蒸馏的温度控制在85~125℃一段时间后,残留液中溶质的主要成份是___。
-
I、废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为__________。
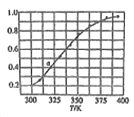
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:

实验过程中应将温度控制在_________。
Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为_______。
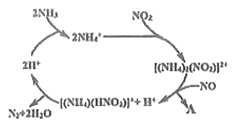
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和__________。
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。
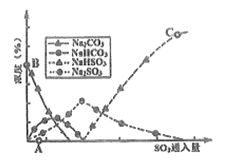
①吸收初期(图中A点以前)反应的化学方程式为__________。
②C点高于B点的原因是__________。
Ⅱ、研究发现,NOx和SO2是雾霾的主要成分。
已知:N2(g)+O2(g)=2NO(g) ΔH=+1805kJ/mol①
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol②
2C(s)+O2(g)=2CO(g) ΔH-221.0kJ/mol③
(4)某反应的平衡常数表达式 ,请写出此反应的热化学方程式:__________。
,请写出此反应的热化学方程式:__________。
(5)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是_______(填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该分应平衡常数保持不变
e.NO和CO的体积比保持不变
(6)2SO(g) 2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=____(用平衡分压代昝平衡浓度计算,分压=总压×物质的量分数)。
2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=____(用平衡分压代昝平衡浓度计算,分压=总压×物质的量分数)。
-
某废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,某化学实验小组设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。

回答下列问题:
(1)写出向废液中加入过量铁粉发生反应的离子方程式______________________。
(2)沉淀A中含有的金属单质是_______________ 。
(3)下列物质中,可以用作试剂X的是_____________ (填写序号)。
A.BaCl2 B.BaCO3 C.NaOH D.Ba(OH)2
(4)向溶液B中通入Cl2的作用是__________________;实验过程中该小组同学用NaCl固体、MnO2和浓硫酸混合加热的办法制得Cl2,写出反应的化学方程式________________;由于Cl2有毒,某同学建议用双氧水替换,请写出向溶液B中加入双氧水后发生反应的离子方程式__________________。
I3-、I-、I2、I3-的平衡体系溶液呈黄色
[FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。








 ,请写出此反应的热化学方程式:__________。
,请写出此反应的热化学方程式:__________。
