-
废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为_____。
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:
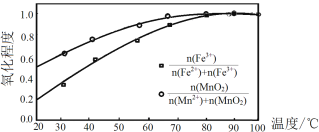
实验过程中应将温度控制在_____。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为_____。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是_____。
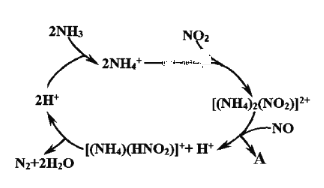
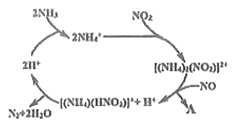
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和_____ 。
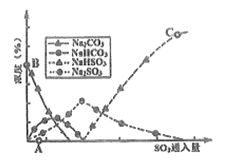
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。
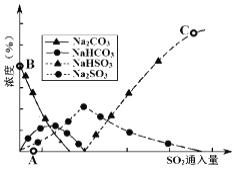
①吸收初期(图中A点以前)反应的化学方程式为_____。
②C点高于B点的原因是_______
-
废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为________________。
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:
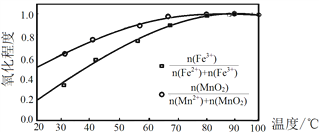
图1
实验过程中应将温度控制在________________。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为________________。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是________________。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图2所示。A包含物质的化学式为N2和________________。
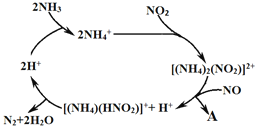
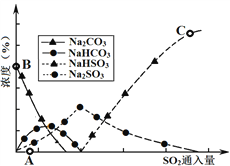
图2 图3
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为________________。
②C点高于B点的原因是________________。
-
废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为________________。
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:

图1
实验过程中应将温度控制在________________。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为________________。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是________________。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图2所示。A包含物质的化学式为N2和________________。
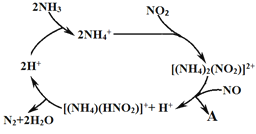
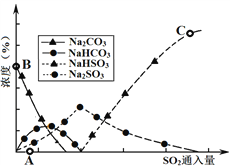
图2 图3
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为________________。
②C点高于B点的原因是________________。
-
I、废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为__________。
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:

实验过程中应将温度控制在_________。
Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为_______。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和__________。
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。
①吸收初期(图中A点以前)反应的化学方程式为__________。
②C点高于B点的原因是__________。
Ⅱ、研究发现,NOx和SO2是雾霾的主要成分。
已知:N2(g)+O2(g)=2NO(g) ΔH=+1805kJ/mol①
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol②
2C(s)+O2(g)=2CO(g) ΔH-221.0kJ/mol③
(4)某反应的平衡常数表达式 ,请写出此反应的热化学方程式:__________。
,请写出此反应的热化学方程式:__________。
(5)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是_______(填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该分应平衡常数保持不变
e.NO和CO的体积比保持不变
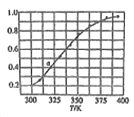
(6)2SO(g) 2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=____(用平衡分压代昝平衡浓度计算,分压=总压×物质的量分数)。
2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=____(用平衡分压代昝平衡浓度计算,分压=总压×物质的量分数)。
-
废水对自然环境有严重的破坏作用,水污染治理刻不容缓,BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是( )
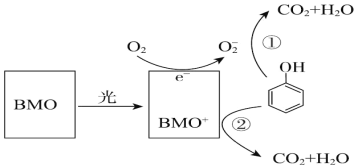
A.该过程中O2-e-=O2-
B.①和②中BMO+和O-都表现较强氧化性
C.催化剂BMO能降低反应的反应热和活化能
D.该过程为放热反应
-
金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水,煤和石油燃烧的废气中也含有颗粒状的铬。
(1)某兴趣小组拟定以下流程,对含Cr3+、Fe2+等离子的废水进行无害化处理。
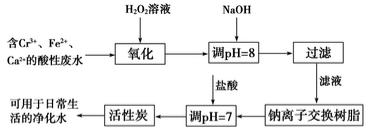
请回答下列问题:
①写出加入双氧水后发生反应的离子方程式:_____________________________。
②过滤操作需要的玻璃仪器有________________________________________。
③活性炭的作用是__________________________________________________。
(2)工业含铬废水中铬常以Cr2O 形式存在,可按下列流程来除去废水中的铬。
形式存在,可按下列流程来除去废水中的铬。
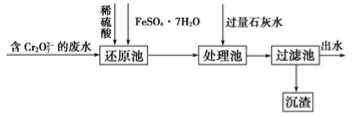
①写出还原池中发生反应的离子方程式:________________________________。
②石灰水处理后生成的沉淀有______(用化学式表示)。
③现处理1×102L含铬(Ⅵ)39 mg·L-1的废水,需要绿矾________g。
-
练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:
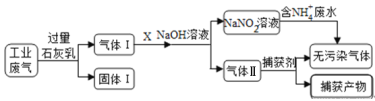
下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
-
练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:
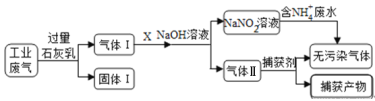
下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
-
(13分)二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中________能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:CO(g)+NO2(g) NO(g)+CO2(g) △H=-akJ·mol—1(a>0)2CO(g)+2NO2(g) N2(g)+2CO2(g) △H=-bkJ·mol—1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为mol,放出的热量为________kJ(用含有a和b的代数式表示)。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(只要求写一种)。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,SO2(g)+1/2O2(g) SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=________。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=________。
②一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是________
2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是________
A.保持温度和容器压强不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
E.升高温度 F.移动活塞压缩气体
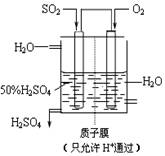
(4)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:________
________。
-
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中______能导致酸雨的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化.如:
CO(g)+NO2(g)═NO(g)+CO2(g)△H=-akJ•mol-1(a>0)
2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-bkJ•mol-1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为______mol,放出的热量为______kJ(用含有a和b的代数式表示).
(2)在火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏.写出有关的化学反应方程式______.
(3)硫酸工业生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g) 2SO3(g)△H=-196.kJ•mol-1
2SO3(g)△H=-196.kJ•mol-1
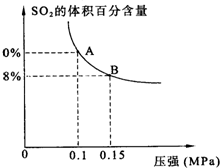
某温度下达到平衡时,SO2的体积百分含量与体系的总压强的关系如图所示:
据此图回答下列问题:
①平衡状态由A变到B时,反应体系______(填“吸收”或“释放”)能量.
②将5molSO2和7molO2通入10L密闭容器中,平衡时体系的总压强为0.1MPa.该反应在该温度下的平衡常数等于______.



 ,请写出此反应的热化学方程式:__________。
,请写出此反应的热化学方程式:__________。2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=____(用平衡分压代昝平衡浓度计算,分压=总压×物质的量分数)。
















