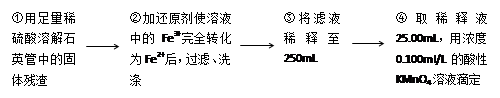-
中国是钢铁生产大国,也是铁矿石消费大国。某铁矿石主要成分为 和
和 ,实验室为测定
,实验室为测定 和
和 的物质的量比,利用下图所示装置进行实验。
的物质的量比,利用下图所示装置进行实验。
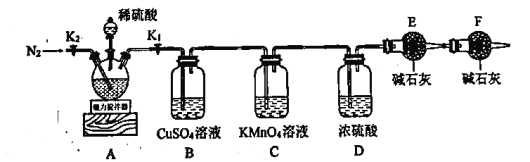
实验步骤如下:
Ⅰ.按图示连接仪器,检查装置气密性后加入药品;
Ⅱ.打开 、
、 ,通入一段时间氮气,关闭
,通入一段时间氮气,关闭 、
、 ,取下干燥管称量其质量(
,取下干燥管称量其质量( )后再连接好装置;
)后再连接好装置;
Ⅲ.打开 和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去
和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去 的稀硫酸(其它杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开
的稀硫酸(其它杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开 通入一段时间氮气;
通入一段时间氮气;
Ⅳ.关闭 、
、 ,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100mL溶液备用;
,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100mL溶液备用;
Ⅴ.取下上述步骤ⅱ中的干燥管并称量其质量( );
);
Ⅵ.取配制好的滤液25mL于锥形瓶中,用 溶液滴定。
溶液滴定。
回答下列问题:
(1)步骤Ⅱ中需要称重的干燥管是_________(填“E”或“F”)。
(2)实验过程中发现B中有黑色沉淀生成,写出装置A中 与稀硫酸反应的化学方程式__________________。
与稀硫酸反应的化学方程式__________________。
(3)C装置的作用是_________;若撤去装置F,则测得的 的含量会_________(填“偏大”“偏小”或“无影响”)。
的含量会_________(填“偏大”“偏小”或“无影响”)。
(4)下列关于步骤Ⅳ的叙述正确的是_________(填标号)。
A.滤渣中含有还原产物单质硫
B.过滤过程中玻璃棒起到引流和搅拌的作用
C.过滤操作要迅速,否则会使测得的 的含量偏低
的含量偏低
D.检验沉淀是否洗涤干净,可向滤液中加入氯化钡溶液,观察是否有白色沉淀生成
(5)步骤Ⅵ中发生反应的离子方程式为_________,到达滴定终点的现象是_________。
(6)若上述实验中 ,步骤Ⅵ消耗
,步骤Ⅵ消耗 溶液45mL,则该矿石样品中
溶液45mL,则该矿石样品中 _________。
_________。
-
(11分)实验室可以用下图装置进行CO还原赤铁矿(主要成分为Fe2O3)并测定其中铁的含量的实验(假设杂质不参加反应)。请回答下列问题:
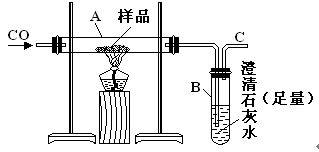
(1)该实验中炼铁的方法是________填字母)。
A、热分解法 B、热还原法 C、电解法 D、湿法冶金
(2)实验开始后,B中的现象是________ 。
A中有关反应的化学方程是________ 。
(3)C处须进行尾气处理,其方法是 ________ 。
(4)若样品的质量为3.6g,通入足量的CO充分反应后,B增重2.64g,则样品中铁的质量分数为________(结果保留一位小数)。
-
(16分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
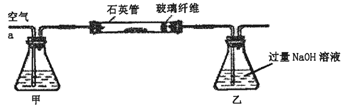
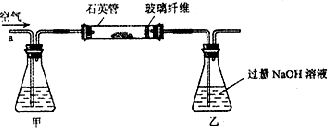
I.将m,g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。

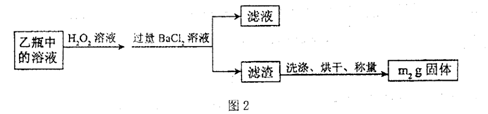
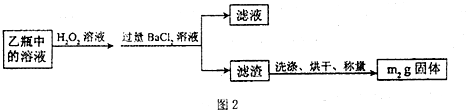
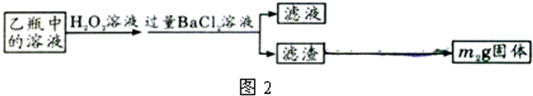
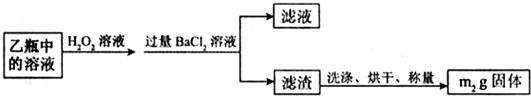
II.反应结束后,将乙瓶中的溶液进行如图2处理。
[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是________。
(2)I中,甲瓶内所盛试剂是________溶液;乙瓶内发生反应的离子方程式有________;I中玻璃纤维的作用是________。
(3)II中,所加H2O2溶液需足量的理由是。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有________;
(5)该黄铁矿中硫元素的质量分数________(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数________(用I、II中有关实验数据表达)
-
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.

II.反应结束后,将乙瓶中的溶液进行如图2处理.
[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是______.
(2)I中,甲瓶内所盛试剂是______溶液;乙瓶内发生反应的离子方程式有______;I中玻璃纤维的作用是______.
(3)II中的滤渣在称量前还应进行的操作是______;II中,所加H2O2溶液需足量的理由是______.
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有______;④中取稀释液25.00mL需用的仪器是______.
(5)该黄铁矿中硫元素的质量分数______(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数______(用I、II中有关实验数据表达)
-
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:

 [实验二]测定铁元素的含量。
[实验二]测定铁元素的含量。
III、测定铁元素含量的实验步骤如图所示。
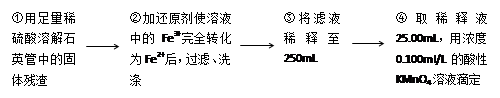
问题讨论:
(1)I中,甲瓶内所盛试剂是____溶液。乙瓶内发生反应的离子方程式为____。
(2)II中,乙瓶加入H2O2溶液时反应的离子方程式为_____________________。
(3)该黄铁矿中硫元素的质量分数为_______________________。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有____________________________________________。
(5)III的步骤④中,表示滴定已达终点的现象是________
(6)Ⅲ的步骤④进行了三次平行实验,测得消耗KMnO4溶液体积分别为24.98mL、24.80mL、25.02mL(KMnO4被还原为Mn2+)。根据上述数据,可计算出该黄铁矿样品铁元素的质量分数为。
-
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料.某化学学习小组对某黄铁矿石进行如下实验探究.[实验一]测定硫元素的含量.
Ⅰ、将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2.
2Fe2O3+8SO2.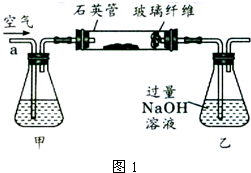
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理.
[实验二]测定铁元素的含量.
Ⅲ、测定铁元素含量的实验步骤如图3所示.

问题讨论:
(1)Ⅰ中,甲瓶内所盛试剂是______溶液.乙瓶内发生反应的离子方程式有:______、______.
(2)Ⅱ中的滤渣在称量前还应进行的操作是______.
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是______.
(4)④中取稀释液25.00ml需用的仪器是______.Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有______(画出其简易装置图).
(5)该黄铁矿中硫元素的质量分数为______.
-
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料.某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究.
【实验一】:测定硫元素的含量
I.将m1g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体.写出石英管中发生反应的化学方程式为:______ 2Fe2O3+8SO2
-
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
(1)I中,甲瓶内所盛试剂是______溶液.乙瓶内发生反应的离子方程式有______、______.
(2)Ⅱ中,所需H2O2溶液足量的理由是______.
(3)该黄铁矿石中硫元素的质量分数为______.
[实验二]:设计以下实验方案测定铁元素的含量
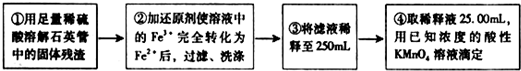
问题讨论:
(4)②中,若选用铁粉作还原剂.你认为合理吗?______.
若不合理,会如何影响测量结果:______(若合理,此空不答).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有______.
(6)④中发生反应的离子方程式为______.
-
(15分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为: 。
。
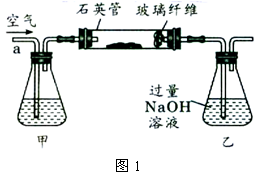
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。

[实验二]测定铁元素的含量。
Ⅲ、测定铁元素含量的实验步骤如图3所示。

问题讨论:
(1)Ⅰ中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有:________、________。
(2)Ⅱ中的滤渣在称量前还应进行的操作是________。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是________。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
④中取稀释液25.00ml需用的仪器是________。
(5)该黄铁矿中硫元素的质量分数为。
-
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料.某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究.
[实验一]测定黄铁矿中硫元素的含量
Ⅰ.将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)Ⅰ中,石英管中发生的反应方程式为______ 2Fe2O3+8SO2
和
,实验室为测定
和
的物质的量比,利用下图所示装置进行实验。

、
,通入一段时间氮气,关闭
、
,取下干燥管称量其质量(
)后再连接好装置;
和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去
的稀硫酸(其它杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开
通入一段时间氮气;
、
,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100mL溶液备用;
);
溶液滴定。
与稀硫酸反应的化学方程式__________________。
的含量会_________(填“偏大”“偏小”或“无影响”)。
的含量偏低
,步骤Ⅵ消耗
溶液45mL,则该矿石样品中
_________。