-
某处工厂排出的烟道气中含氮氧化物(主要为NO、NO2)、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示:
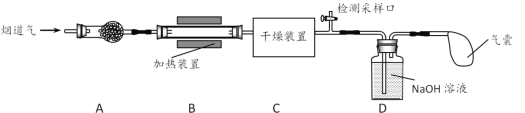
(1)装置A中放置无碱玻璃棉,其目的是除去___________。为保证检测的准确性,装置C中盛放的化学试剂可以是___________(填字母)。
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4·5H2O)
(2)装置D中主要发生:2NaOH+2NO2=NaNO2+NaNO3+H2O;2NaOH+NO+NO2=2NaNO2+H2O
①若反应后尾气无残留,则参加反应的NO2、NO物质的量比值为_______(填字母)。
a.≥1 b.≤1 c.任意值
②可使用适量酸性H2O2溶液,将溶液中的NO2-全部氧化为NO3-,发生反应的离子方程式是___________。
(3)溶液中NO3-直接排放在水体中也会造成污染,现用活泼金属将溶液中NO3-转化为N2,实现氮元素的脱除,具体步骤如下:
步骤一、取适量(2)中H2O2处理后的溶液,调节pH至中性,蒸发浓缩,得到c(NO3-)为0.100mol·L-1的溶液甲。
步骤二、现量取50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中对溶液乙进行氮脱除。
步骤三、重复实验2~3次,溶液中NO3-的残留情况与反应时间的关系如图所示。

①金属铝和金属铁在0~3h内,NO3-的脱除效率均很低,几乎没被脱除,其可能的原因是___________。
②0~3h内铝铁合金的氮脱除效率比金属铝、金属铁大得多,其可能的原因________。
(4)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性NaClO溶液来处理。HClO氧化NO生成NO3-和Cl-,发生反应的离子方程式是___________。
-
燃煤烟气中含有二氧化硫等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
I.为测定某工厂烟道气中SO2的含量,某兴趣小组同学做了如下实验: 取标准状况下的烟气1.000L (内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g。
(1) 写出氯水与二氧化硫反应的离子方程式__________。
(2) 加入过量的BaCl2溶液的日的是: ____________,写出相关反应的离子方程式:__________。
(3) 洗涤沉淀的方法是____________。
(4) 计算该烟气样品中二氧化硫的体积分数___________。
II.燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(5) 在工业上采用氨法烟气脱硫技术,其做法是用雾化的氨水与烟气中的SO2直接接触吸收SO2,请写出氨水吸收SO2 生成亚硫酸铵的化学方程式_________。
(6) 该兴趣小组同学采用NaClO2溶液脱除SO2
①NaClO2 中氯元素的化合价为_______。
②用1L0.1mol/L 的NaClO2溶液最多可以吸收标准状况下的SO2_____L。
-
某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
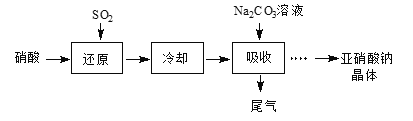
已知:Ⅰ.Na2CO3 + NO + NO2 = 2NaNO2 + CO2;
Na2CO3 + 2NO2 = NaNO2 + NaNO3 + CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是________。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是______。
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为_____。
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000 g样品,将其配成250 mL溶液。
b.先向锥形瓶内加入40.00 mL 0.100 mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00 mL 0. 100 mol·L-1 KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00 mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度____(“偏大”、“偏小”或“无影响”),原因是_______。
②通过计算,该样品中NaNO2的质量分数是_____,可能含有的杂质有________(写出其中两种)。
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是____。
-
某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
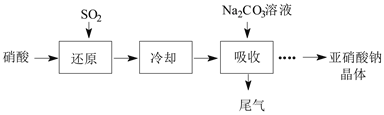
已知:Ⅰ.Na2CO3+NO+NO2=2NaNO2+CO2;Na2CO3+2NO2=NaNO2+NaNO3+CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是___(填元素符号)。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___。
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为___。
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00mL0.100mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL0.100mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度___(“偏大”、“偏小”或“无影响”),原因是___。
②通过计算,该样品中NaNO2的质量分数是___,可能含有的杂质有___(写出其中一种即可)。
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是___。
-
(8分)某校化学兴趣小组对附近一化工厂排出的污水进行监测。发现污水中含某些金属离子对水质和环境造成了严重污染。他们曾对该厂排出的污水取样、过滤,对滤液进行了多次检测,其中有三次检测结果发现有如下物质:①CuCl2、FeCl3、MgSO4、H2SO4;②CuSO4、 MgCl2、Fe2 (SO4)3、HCl;③CuSO4、AgNO3、FeCl3、HCl。试回答:
(1)三次检测的结果中第________次检测的结果不正确。
(2)研究小组根据检测结果,向化工厂提出建议:用一种含钠离子的化合物来处理污水,就可以同时除去检测出的金属离子。这种化合物是_____________。
(3)在检测时,为了确定滤液中是否存在硫酸根离子和氯离子,同学们将滤液酸化后,首先向滤液中加入过量的_____________溶液,将反应后的混合物过滤,再向得到的滤液中加入_____________溶液。
-
无水氯化铝常作为有机合成和石油化工的催化剂,并用于处理润滑油等。工业上可由金属铝和纯净的氯气作用制备。某课外兴趣小组在实验室里,通过下图所示装置,制取少量纯净的无水氯化铝。据此回答下列问题:
查阅资料:常温下,无水氯化铝为白色晶体,易吸收水分,在178℃升华。装有无水氯化铝的试剂瓶久置潮湿空气中,会自动爆炸并产生大量白雾。
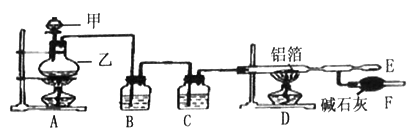
(1)写出A装置中,实验室制取Cl2的离子方程式________________。
(2)仪器甲______(写名称);仪器乙________(写名称)
(3)在E处可收集到纯净的氯化铝,F装置所起的作用是__________。
(4)装置B、C中的试剂分別是_________________。
(5)从A装置中导出的气体若不经过B、C装置而直接进入D装置中,产生的后果是______________。
-
(16分)某课外活动小组探究镁与CO2、NO2的反应。
I、实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体分别是C和MgO;该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测:写出Mg在NO2中燃烧的化学方程式 。反应产生的固体中可能存在 物质(填化学式)。
II、设计实验验证以上猜测(用于连接玻璃管的乳胶管均内衬锡纸)

资料信息:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
(1)写出A中发生反应的化学方程式: ;
(2)装置B中盛装的干燥剂是(填序号)___________________;
①浓硫酸 ②无水CaCl2 ③碱石灰
(3)实验开始时正确的操作步骤是___ ___;
a.打开A装置中分液漏斗的旋塞滴入浓硝酸制取NO2
b.打开活塞K
c.点燃C处酒精灯
d.当C处硬质玻璃管内充满红综色气体后,关闭活塞K
(4)D中NaOH溶液盛的很满,这样做的目的是____________ _____________;
(5)本实验中存在明显缺陷,改进措施是____________________________________。
-
二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:

(1)甲装置中圆底烧瓶内发生反应的化学方程式是_________________________________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。戊装置的作用是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO 、ClO
、ClO ,该反应的离子方程式是_______________________________________。
,该反应的离子方程式是_______________________________________。
-
二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:
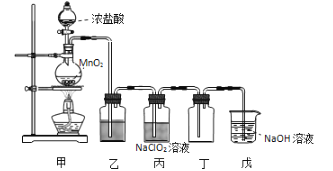
(1)甲装置中圆底烧瓶内发生反应的化学方程式是____________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。实验过程中常需通入适量的 N2稀释 ClO2,其目的是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO2-、ClO3-,该反应的离子方程式是__________。
-
二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:

(1)甲装置中圆底烧瓶内发生反应的化学方程式是_________________________________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。戊装置的作用是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO 、ClO
、ClO ,该反应的离子方程式是_______________________________________。
,该反应的离子方程式是_______________________________________。








