-
氯气是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
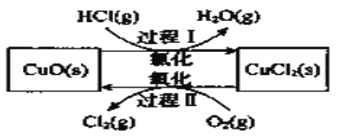
过程 I 的反应为, 2HCl(g)+CuO(s)  CuCl2(s)+H2O(g)△H= -132kJ/mol
CuCl2(s)+H2O(g)△H= -132kJ/mol
(1)该原理中起到催化剂作用物质的化学式为_______________________;
(2)过程 II 反应的热化学方程式为____________________;
(3)压强为p1时,地康法中HCl 的平衡转化率aHCl 随温度变化曲线如图。
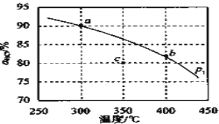
①比较 a、b 两点的平衡常数大小 K(a)=_______________K(b)(填“>”“<”或“=”),解释原因为________________;
②c 点表示投料不变, 350℃、压强为p2时,地康法中HCl 的平衡转化率,则p2_________________p1(填“>”“<”或“=”)。
-
 是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:
是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为: 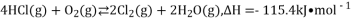 。该反应分两步进行,其基本原理如下图所示:
。该反应分两步进行,其基本原理如下图所示:
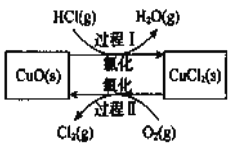
过程I的反应为,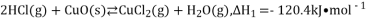
(])该原理中, 的作用是_____________
的作用是_____________
(2)过程II反应的热化学方程式为____________
(3)压强为 时,地康法中
时,地康法中 的平衡转化率
的平衡转化率 随温度变化曲线如图。
随温度变化曲线如图。
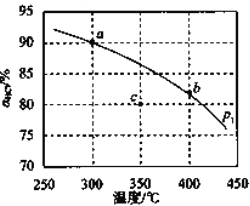
①平衡常数比较:K(a)____________K(b)(填">“<"或“-").
②c点表示投料不变, 、压强为
、压强为 时,地康法中HCl的平衡转化率,则p2_____________p1(填“>”“<”或“=”),理由是___________。
时,地康法中HCl的平衡转化率,则p2_____________p1(填“>”“<”或“=”),理由是___________。
-
 是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:
是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为: 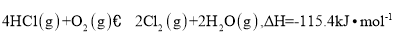 。该反应分两步进行,其基本原理如下图所示:
。该反应分两步进行,其基本原理如下图所示:
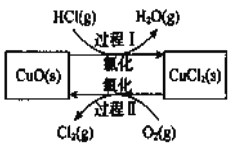
过程I的反应为,
(])该原理中, 的作用是_____________
的作用是_____________
(2)过程II反应的热化学方程式为____________
(3)压强为 时,地康法中
时,地康法中 的平衡转化率
的平衡转化率 随温度变化曲线如图。
随温度变化曲线如图。
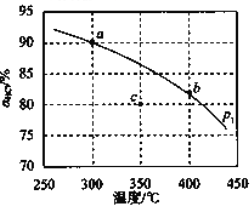
①平衡常数比较:K(a)____________K(b)(填">“<"或“-").
②c点表示投料不变, 、压强为
、压强为 时,地康法中HCl的平衡转化率,则p2_____________p1(填“>”“<”或“=”),理由是___________。
时,地康法中HCl的平衡转化率,则p2_____________p1(填“>”“<”或“=”),理由是___________。
-
氯气是一种重要的化工原料,在生产和生活中应用十分广泛.在实验室可用二氧化锰固体和浓盐酸制氯气.
(1)请为该实验选择合适的发生装置______(填A或B),写出仪器①的名称______
(2)当集气瓶中收集满氯气时,可以观察到气体呈______色.尾气通常用______吸收.
(3)工业上常用电解饱和食盐水制取氯气,试写出该反应的化学方程式:______ 2NaOH+H2↑+Cl2↑
-
(6分) 氯气是一种重要的化工原料,在生产和生活中应用十分广泛。在实验室可用二氧化锰固体和浓盐酸制氯气。
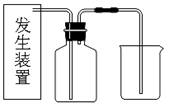
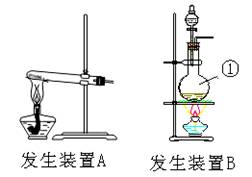
(1)请为该实验选择合适的发生装置________________________(填A或B),写出仪器①的名称________
(2)当集气瓶中收集满氯气时,可以观察到气体呈________________________色。尾气通常用________________________吸收。
(3)工业上常用电解饱和食盐水制取氯气,试写出该反应的化学方程式:
。
-
氯气及其化合物在生产生活中有重要的应用。
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
| 化学键 | H-Cl | O=O | Cl – Cl | H-O |
| E(kJ·mol-1 | a | b | c | d |
则该反应的△H=______________。(用含a、b、c、d的代数式表示)
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g)  CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
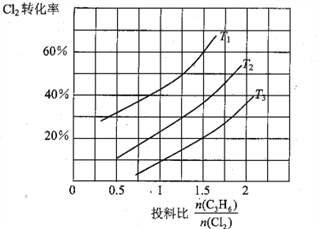
①该反应的△H______________0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是______________ (填标号)。
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为______________mol·〔L·min)-1,平衡常数K为______________,保持温度不变,减小投料比 ,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是____________________________。
-
文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g) 2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化率影响的曲线如图.
2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化率影响的曲线如图.
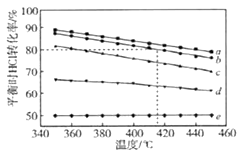
请回答下列问题:
(1)可以判断该反应已经达到化学平衡的是__. (填字母).
A.密闭容器中总压强不变 B.密闭容器中混合气体的密度不变
C.v(HCl)=2v(Cl2) D.密闭容器中氯气的体积分数不变
(2)d曲线对应的投料比是__(填比值,从题干中选择,下同).有机工业需要含O2量低的氧气和氯化氢混合气体,可控制n(HCl):n(O2)=_______制备.
(3)该反应的平衡常数表达式为________.
(4)若按b曲线对应的投料比进行反应,且温度为415℃,反应达到平衡时Cl2的体积分数为_______.
-
甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。
已知:光催化制氢:2H2O(l)==2H2(g)+O2(g) ΔH=+571.5 kJ/mol
H2与CO2耦合反应:3H2(g)+CO2(g)==CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol
则反应:2H2O(l)+CO2(g) == CH3OH(l)+3/2O2(g)的ΔH= kJ/mol
你认为该方法需要解决的技术问题有 。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应(填“I”或“II”。下同)制甲醛的原子利用率更高 。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。(原子利用率表示目标产物的质量与生成物总质量之比。)
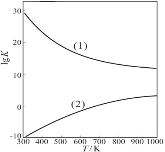
②右图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示 (填“I”或“II”)的反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为
NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式:
(4)某溶液中发生反应:A 2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
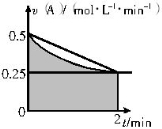
A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol・L-1・min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,B的物质的量浓度c(B)介于1~1.5mol・L-1之间
-
下列说法不正确的是( )
A. 氯气是一种重要的化工原料,广泛应用于自来水的消毒和农药的生产等方面
B. 钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂
C. 用二氧化硅制造的光导纤维具有很强的导电能力,可用于制作光缆
D. 化肥的生产、金属矿石的处理、金属材料的表面清洗等都可能用到硫酸
-
氨气在生产、生活和科研中应用十分广泛。
(1)①SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),SNCR-SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g)  4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1;
4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1;
6NO(g)+4NH3(g)  5N2(g)+6H2O(g)△H=-1807.0kJ•mol-1;
5N2(g)+6H2O(g)△H=-1807.0kJ•mol-1;
6NO2(g)+8NH3(g)  7N2(g)+12H2O(g)△H=-2659.9kJ•mol-1;
7N2(g)+12H2O(g)△H=-2659.9kJ•mol-1;
反应N2(g)+O2(g)  2NO(g)的△H= ____________ kJ•mol-1
2NO(g)的△H= ____________ kJ•mol-1
②液氨可以发生电离:2NH3(l)  NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式____________;
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式____________;
(2)氨气易液化,便于储运①若在恒温恒容的容器内进行反应2NH3(g)  N2(g)+3H2(g);△H=+94.4kJ/mol,下列表示该反应达到平衡状态的标志有____________(填字母序号)
N2(g)+3H2(g);△H=+94.4kJ/mol,下列表示该反应达到平衡状态的标志有____________(填字母序号)
A.容器中混合气体的密度保持不变
B.NH3(g)百分含量保持不变
C.容器中混合气体的压强保持不变
D.有3个H-H键生成同时又1个N≡N键生成
②其他条件相同时,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度的变化如图所示.在600℃时催化效果最好的是____________(填催化剂的化学式).c点氨气的转化率高于b点,原因是____________。
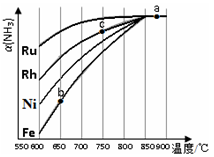
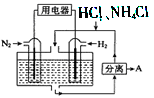
(3)如图表示使用新型电极材料,以N2、H2 为电极反应物,以HCl-NH4Cl为电解质溶液组成的既能提供能量又能实现氮固定的新型电池。请写出该电池的正极反应式____________;生产中可分离出的物质A的化学式为____________。
2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:

CuCl2(s)+H2O(g)△H= -132kJ/mol

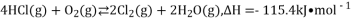 。该反应分两步进行,其基本原理如下图所示:
。该反应分两步进行,其基本原理如下图所示:
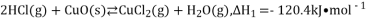

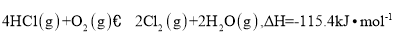 。该反应分两步进行,其基本原理如下图所示:
。该反应分两步进行,其基本原理如下图所示:









