-
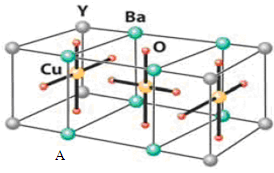
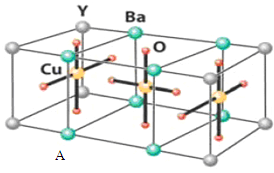
(10分)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为 。
(2)元素N、P、S的第一电离能(I1)由大到小的顺序为 。
(3)HN3属于 晶体,与N3-互为等电子体的分子的化学式 (写1种)NH2-的电子式为 ,其中心原子的杂化类型是 。
(4)CuCl2-中的键型为 ,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为 。
(5)治癌药物B的结构简式为 。
-
HN3称为叠氮酸,常温下为无色有刺激性气味的液体。 也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成
也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成 。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为__________________。
(2)元素N、P、S的第一电离能(I1)由大到小的顺序为___________。
(3)HN3属于________晶体,与 互为等电子体的分子的化学式__________(写1种),
互为等电子体的分子的化学式__________(写1种), 的电子式为_________,其中心原子的杂化类型是________________。
的电子式为_________,其中心原子的杂化类型是________________。
(4) 中的键型为__________,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为___。
中的键型为__________,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为___。
(5)治癌药物B的结构简式为_______________________。
-
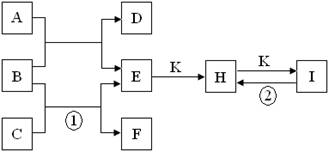
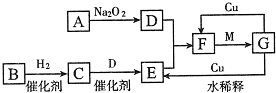
(8分)下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
请回答下列问题:
(1)物质A的化学式为__________。
(2)化合物E的电子式为__________。
(3)反应①的离子方程式为__________;反应②的化学方程式为__________。
-
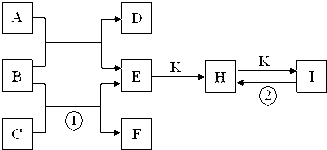
如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体.(反应中生成的部分物质已略去)
请回答下列问题:
(1)物质A的化学式为______.
(2)化合物E的电子式为______.
(3)反应①的离子方程式为______;反应②的化学方程式为______ Na2CO3+H2O+CO2↑
-
1,2,3,4—四氢化萘的结构简式如下图, 分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+ 4Br2→ C10H8Br4+ 4HBr生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:


①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。
②慢慢滴入液溴,不断搅拌,直到反应完全。
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。
④ 分液,得到的“水层”即氢溴酸溶液。
回答下列问题:
(1) 如图所示的装置, 适合步骤①和②的操作的是________。
(2) 步骤②中如何判断“反应完全”_________________________________________。
(3) 步骤③中补充少量四氢化萘的目的是________。
(4) 步骤③中过滤后得到的固体物质是_____________________________。
(5) 已知在实验条件下,饱和氢溴酸溶液中氢溴酸的质量分数是66%,如果溴化反应进行完全,则步骤①中水和四氢化萘的质量比约是1:____________(保留小数点后1位)。
-
下面关于甲醛的几种说法中,正确的是
A. 它在常温、常压下是一种无色有刺激性气味的液体
B. 甲醛俗称为福尔马林,可用来浸制生物标本
C. 装修房子的很多材料中都会散发出甲醛等有害气体
D. 甲醛溶液可以浸泡海产品,以防止产品变质
-
下列关于甲醛的描述中不正确的是 ( )
A. 常温下是无色有刺激性气味的气体 B. 可制作福尔马林,用于漂白食品
C. 能发生银镜反应 D. 既具有氧化性,又具有还原性
-
下面关于甲醛的几种说法中,正确的是
A.它在常温、常压下是一种无色有刺激性气味的液体
B.现代装修房子的很多材料中都会散发出甲醛等有害气体
C.纯甲醛俗称为福尔马林,可用来浸制生物标本
D.甲醛溶液可以浸泡海鲜产品,以防止产品变质
-
二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水。某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如下图所示。请回答下列问题:
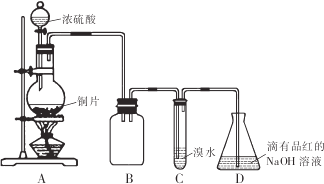
(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到的目的是 (填序号)
a.用酸碱中和滴定法测定
b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值
d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是 ,设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式 ,装置D中NaOH全部转化为NaHSO3的标志是____________
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完; Ⅱ.NaClO不足; Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:(已知酸性:H2SO3>H2CO3>HClO)
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 加入几小块CaCO3固体 | 有气泡产生 | |
| ② | 滴加少量淀粉KI溶液,振荡 | | Ⅲ |
| ③ | 滴加少量溴水,振荡 | | Ⅱ |
| ④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 | |
(4)设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小 。
-
如图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去).各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
(1)物质F的化学式:______.
(2)物质B的电子式:______.
(3)写出C→E的化学方程式:______高温高压4NO+6H2O
也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成
。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:

互为等电子体的分子的化学式__________(写1种),
的电子式为_________,其中心原子的杂化类型是________________。
中的键型为__________,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为___。





