-
某小组用实验I验证Fe2(SO4)3与Cu的反应,观察到了异常现象,决定对其进行深入探究。
实验I:
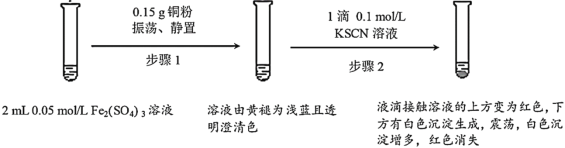
(1)Fe2(SO4)3溶液常温下呈酸性的原因是___。
(2)Fe2(SO4)3与KSCN溶液反应的离子方程式为___。
(3)实验前,小组同学预测经过步骤2后溶液不应该呈现红色,依据是__。
(4)实验小组对白色沉淀的产生进行了深入探究
查阅资料:i.CuSCN为难溶于水的白色固体。
ii.SCN-被称为拟卤素离子,性质与卤素离子相似
经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能
猜测1:Cu2+与KSCN发生了氧化还原反应
猜测2:亚铁离子将其还原Cu2++Fe2+=Cu++Fe3+,Cu++SCN-=CuSCN↓
为证实猜想小组同学做了实验II和III。(FeSO4和CuSO4溶液浓度为0.1mol/L,KSCN溶液浓度为0.4mol/L)
| 实验序号 | 对比实验及试剂 | 实验步骤 | 实验现象 |
| II |  A试管溶液2mLFeSO4 A试管溶液2mLFeSO4
| 加入1mLKSCN溶液 | 开始时溶液的上方变为红色,一段时间后红色向下蔓延,最后充满整支试管 |
|  B试管2mLCuSO4溶液 B试管2mLCuSO4溶液
| 加入1mLKSCN溶液 | 溶液变成绿色 |
①猜测1的离子方程式____;
②实验II中试管__(填字母)中的现象可以证实猜测1不成立。
| 实验序号 | 对比实验及试剂 | 实验步骤 | 实验现象 |
|  C试管2mLFeSO4溶液 C试管2mLFeSO4溶液
| 加入2mLCuSO4溶液 | 溶液变为淡蓝色 |
| 再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈红色 |
|  D试管2mLFeSO4溶液 D试管2mLFeSO4溶液
| 加入4mLCuSO4溶液 | 溶液变为淡蓝色 |
| 再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈浅红色 |
|  E试管4mLFeSO4溶液 E试管4mLFeSO4溶液
| 加入2mLCuSO4溶液 | 溶液变为淡蓝色 |
| 再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈深红色 |
(5)Fe3+的氧化性本应强于Cu2+,结合实验III中的现象解释Cu2++Fe2+=Cu++Fe3+能正向发生的原因是___。
(6)实验小组查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析生成CuSCN沉淀使Cu2+的氧化性增强,并补充实验进一步证明。补充的实验是___。
-
某小组用实验 1验证FeCl3与 Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
实验1:
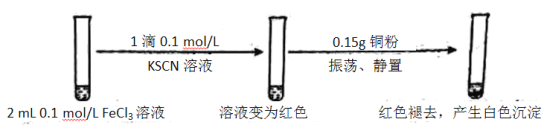
资料:ⅰ. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42—、Cu2+与Cl—。
ⅱ. SCN—被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与溴单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为__________。
(2)下列由实验1得到的推论中,合理的是__________。(填字母序号)
a.Cu能还原Fe3+
b.Fe3+与SCN—的反应是可逆反应
c.白色沉淀中的Cu(Ⅰ)(Ⅰ表示+1 价铜元素)可能是由 Fe3+氧化Cu 得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
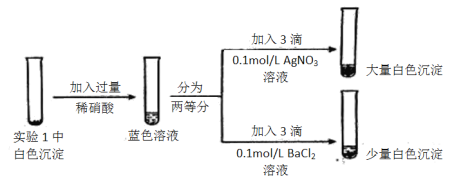
由实验2可知,实验1中白色沉淀的成分是__________。
(4)该小组欲进一步探究实验 1中白色沉淀产生的原因,实施了实验3:
| 步骤 | 实验操作 | 实验现象 |
| Ⅰ | 向2mL 0.1mol/L的FeCl3溶液中加入0.15g Cu粉 | 溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 |
| Ⅱ | 取Ⅰ中上层清液于试管中,滴加 1滴 0.1mol/L KSCN溶液 | 有白色沉淀生成,且溶液出现红色 |
| Ⅲ | 振荡Ⅱ中试管,静置 | 白色沉淀变多,红色逐渐褪去 |
①步骤Ⅰ中反应的离子方程式为___________________。
②根据实验 3 的现象,小组同学认为 Fe3+与Cu 反应的氧化产物不含Cu(Ⅰ),他们的判断依据是_______________________________。
③步骤Ⅱ中加入KSCN溶液后出现红色的可能原因是______________。
④解释步骤Ⅲ中实验现象产生的可能原因:___________。
-
某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
| 编号 | 实验I | 实验II | 实验III |
| 实验步骤 | 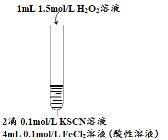
| 将实验I褪色后的溶液分三份分别进行实验 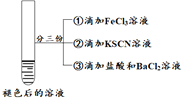
| 为进一步探究“红色褪去”的原因,又进行以下实验 ①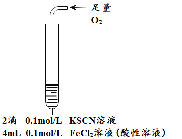 ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
| 现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
-
某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
| 编号 | 实验I | 实验II | 实验III |
| 实验步骤 | 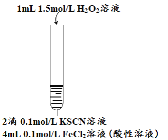
| 将实验I褪色后的溶液分三份分别进行实验 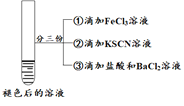
| 为进一步探究“红色褪去”的原因,又进行以下实验 ①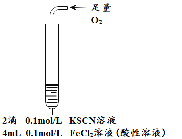 ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
| 现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
-
某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告。
| 物质 | 类别 | 化学性 质预测 | 实验验证 |
| 实验操作 | 实验现象 | 实质(用离子 方程式表示) |
| 二氧 化硫 | 酸性 氧化物 | 与水 反应 | 将盛满SO2气体的试管倒立在水中,并测定试管中溶液的pH | ① | SO2+H2O  H2SO3 H2SO3
|
| 与碱 反应 | ② | 出现白 色沉淀 | ③ |
| | | | | |
(2)该探究小组还根据SO2中S元素的化合价,预测并通过实验探究SO2的其他性质。探究过程中选用的实验药品有:浓硫酸、亚硫酸钠固体、Na2S溶液、酸性高锰酸钾溶液、品红溶液等。探究过程的实验装置图如图所示,请回答下列问题。
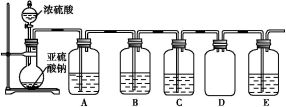
①请你完成下列表格。
| 装置 | 药品 | 作用 |
| A | | 验证二氧化硫的还原性 |
| B | | |
| C | 品红溶液 | |
②A中发生反应的离子方程式为 。
③实验时C中的实验现象是 。
④D装置的作用是 。E是尾气处理装置,有人认为E装置中可以加入足量的Ba(NO3)2溶液,你认为是否合理,请结合离子方程式加以说明: 。
-
某小组同学在实验室里对Fe3+与I﹣的反应进行探究,实现Fe3+与Fe2+相互转化.
(1)甲同学首先进行了如下实验:
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2mL0.1mol•L﹣1FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | ___________________ ___________________ |
| Ⅱ | 先向2mL0.1mol•L﹣1FeCl3溶液中滴加KSCN溶液,再滴加0.1mol•L﹣1KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加0.1mol•L﹣1KI溶液后,血红色无明显变化 |
实验Ⅰ中发生反应的离子方程式为 , .
(2)实验II的现象与预测不同,为探究可能的原因,甲同学又进行了如下实验,
操作及现象如下:
| 编号 | 操作 | 现象 |
| Ⅲ | 向2mL0.1mol•L﹣1KI溶液中滴加1mL 0.1mol•L﹣1FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
根据实验Ⅲ,该同学认为Fe3+有可能与I﹣发生氧化还原反应.请结合实验现象说明得出该结论的理由: .
(3)乙同学认为,还需要进一步设计实验才可证明根据实验Ⅲ中现象得出的结论.
请补全下表中的实验方案:
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2mL0.1mol•L﹣1KI溶液中滴加1mL 0.1mol•L﹣1 FeCl3,溶液变黄色,取该溶液于两支试管中, 试管①中滴加 , 试管②中滴加 . | 预期现象① , ② . 结论 . |
(4)上述实验结果表明,Fe3+有可能与I﹣发生氧化还原反应.进一步查阅资料知,参加反应的Fe3+和I﹣物质的量相同.该小组同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红色的原因,认为Fe3+与I﹣反应的离子方程式应写为: .
-
(5分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出):
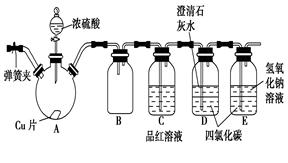
请回答下列问题:
(1)加热过程中,观察到A容器中出现大量白色烟雾,随着反应的进行,底部有白色沉淀生成,该沉淀物是________。
(2)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D容器中澄清石灰水出现浑浊或沉淀。你的猜想是_______。设计实验验证你的猜想_____________。
-
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液.向0.1mol·L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
实验二:向2mL FeCl2溶液中滴加2滴0.1mol·L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:________________。
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
Ⅲ.向2mL 0.1mol·L-1 FeCl3溶液中滴加2滴0.1mol·L-1KSCN溶液,变红,通入O2,无明显变化。
①实验I的说明__________________;
②实验Ⅲ的目的是____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)①甲直接用FeCl2·4H2O配制_________mol·L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去,进一步探究其原因:
②.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH约为3.由此,乙认为红色不褪去的可能原因是:____________________。
③.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1mol·L-1 FeCl3溶液 | |
-
(16分)
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | ③ | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 | ④ |
-
(16分)
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | ③ | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 | ④ |










