-
蓝色钾盐水合物KaCub(C2O4)c·H2O(铜元素为+2价)的组成可通过下列实验确定:
步骤①:称取一定质量的样品置于锥形瓶中,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.0200 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00 mL(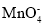 的还原产物为Mn2+)。
的还原产物为Mn2+)。
步骤②:充分加热滴定后的溶液,冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI,发生反应2Cu2++4I-=2CuI↓+I2
步骤③:加入少量淀粉溶液作指示剂,用0.0200 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液15.00 mL,发生反应I2+2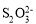 =2I-+
=2I-+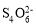
(1)若步骤②中未对滴定后的溶液进行加热,则测出的Cu2+的物质的量将____(填“偏大”、“偏小” 或“不变”) 。
(2)步骤③中滴定终点的现象是___________。
(3)通过计算确定a:b:c=___________。(写出计算过程)
-
蓝色钾盐水合物KaCub(C2O4)c·H2O(铜元素为+2价)的组成可通过下列实验确定:
步骤①:称取一定质量的样品置于锥形瓶中,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.0200 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00 mL(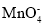 的还原产物为Mn2+)。
的还原产物为Mn2+)。
步骤②:充分加热滴定后的溶液,冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI,发生反应2Cu2++4I-=2CuI↓+I2
步骤③:加入少量淀粉溶液作指示剂,用0.0200 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液15.00 mL,发生反应I2+2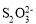 =2I-+
=2I-+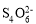
(1)若步骤②中未对滴定后的溶液进行加热,则测出的Cu2+的物质的量将____(填“偏大”、“偏小” 或“不变”) 。
(2)步骤③中滴定终点的现象是___________。
(3)通过计算确定a:b:c=___________。(写出计算过程)
-
(12分)化合物KaFeb(C2O4)c·dH2O(其中铁为正三价)是重要的光化学试剂。通过下述实验确定该晶体的组成。
步骤a:称取该样品4.91g溶于水中配成250mL溶液,取出25mL溶液,向其中加入过量的NaOH溶液,将沉淀过滤,洗涤,高温灼烧至质量不再改变,称量其固体的质量为0.08g。
步骤b:另取出25mL溶液,加入适量稀H2SO4溶液,用0.050 mol·L-1KMnO4溶液滴定,到达滴定终点时,消耗KMnO4溶液24.00mL。
已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O
(1)草酸(H2C2O4)为二元弱酸,其一级电离的方程式为 。草酸的Ka1约为Ka2的1000倍,可能的原因是 。
(2)滴定终点观察到的现象为 。
(3)通过计算确定样品的组成(写出计算过程)。
-
下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量来确定有机物组成。

请回答下列问题:
(1)A装置是提供实验所需的O2,写出有关反应的化学方程式__________;B装置中试剂X可选用_________。
(2)若准确称取0.44g样品(只含C、H、O三种元素中的两种或三种),充分反应后,D管质量增加0.36g,E管质量增加0.88g,则该有机物的实验式为________。
(3)要确定该有机物的分子式,还需知道该有机物的_____________,经测定其蒸气密度是相同条件下H2的22倍,则其分子式为___________。
(4)若该有机物的核磁共振氢谱如图所示,则其结构简式为_____________;
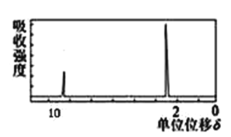
若该有机物只有一种化学环境的氢原子,则其结构简式为___________。
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个E装置,其主要目的是______。
-
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:9.4 g X 6.4 g固体
6.4 g固体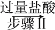 蓝色溶液和1.92 g固体,下列有关说法正确的是
蓝色溶液和1.92 g固体,下列有关说法正确的是
A. 步骤Ⅰ中减小的3 g固体一定是混合物
B. 步骤Ⅱ中质量减少的物质一定是Cu
C. 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D. 根据步骤Ⅱ可以得出m(Fe2O3)∶m(Cu)=1∶1
-
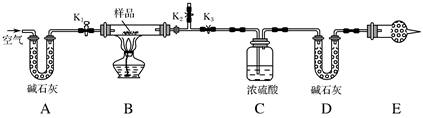
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_________________________________________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是___________________。
②E处干燥管中盛放的药品是________,其作用是__________________ ________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量________(填“偏大”、“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
-
(12分)化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
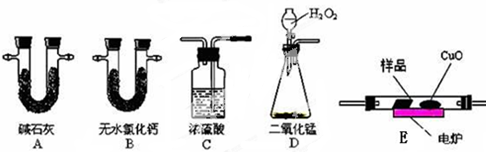
实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:___________(每种装置只用一次);
(2)实验数据记录和处理
| 物理量 实验 序号 | 燃烧有机物的质量 | ① | ② |
| 实验前 质量 | 实验后 质量 | 实验前 质量 | 实验后 质量 |
| 1 | m1 | m2 | m3 | m4 | m5 |
| | | | | |
上表中①、②分别指哪个装置?____________ 、 _____________。
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是________;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式 ,与该有机物相对分子质量相同的烃的一氯代物有 种。
-
硫酸钠-过氧化氢加合物(xNa2SO4•yH2O2•zH2O)的组成可通过下列实验测定:
①准确称取1.7700g 样品,配制成100.00mL 溶液A.
②准确量取25.00mL 溶液A,加入盐酸酸化的BaCl2 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g.
③准确量取25.00mL 溶液A,加适量稀硫酸酸化后,用0.02000mol•L-1KMnO4 溶液滴定至终点,消耗KMnO4 溶液25.00mL.H2O2 与KMnO4 反应的离子方程式如下:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)步骤②中滴定终点的现象为____________;
(2)步骤②中使用盐酸酸化,而步骤③中改用硫酸酸化的原因是____________;
(3)上述滴定若不加稀硫酸酸化,MnO4-被还原为MnO2,其离子方程式为____________;
(4)通过计算确定样品的组成(写出计算过程)。
-
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验,下列有关说法正确的是( )

A.步骤I中减少的3g固体一定是混合物
B.步骤II中质量减少的物质一定是Cu
C.根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D.根据上述步骤II可以得出m(Fe2O3):m(Cu)=1:1
-
(8分)某小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由________。
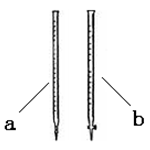
(2)滴定时用________(填a或b)滴定管盛装KMnO4标准溶液。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为________。
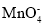 的还原产物为Mn2+)。
的还原产物为Mn2+)。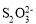 =2I-+
=2I-+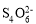
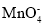 的还原产物为Mn2+)。
的还原产物为Mn2+)。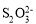 =2I-+
=2I-+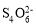


 6.4 g固体
6.4 g固体 蓝色溶液和1.92 g固体,下列有关说法正确的是
蓝色溶液和1.92 g固体,下列有关说法正确的是


