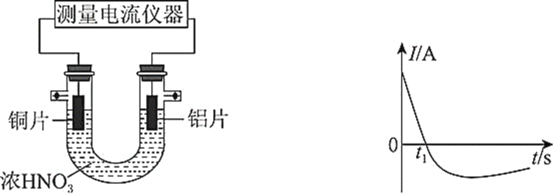
-
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的项重大贡献。
(1)某课外实验小组欲探究铝和铜的金属性(原子失电子能力)强弱,同学们提出了如下实验方案:
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的表现
C.用铝片、铜片、硫酸铝溶液、硫酸铜溶液,比较二者的活动性
D.分别做铝片、铜片与NaOH溶液反应的实验
E.将铝片、铜片用导线连接后共同投入稀盐酸中接入电流计,观察电流方向
上述方案中能达到实验目的的是_____________。
(2)现有如下两个反应:A.NaOH+HCl=NaCl+H2O B.Zn+H2SO4=ZnSO4+H2↑。上述反应中能设计成原电池的是__________(填字母代号),作负极的物质发生了___反应(填“氧化”或“还原”)。
(3)将纯锌片和纯铜片按如图所示方式插入100mL相同浓度的稀硫酸一段时间,回答下列问题:
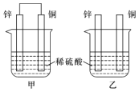
①下列说法正确的是________(填字母代号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲___乙(填“>”、“<”或“=”)。原因是______。
③当甲中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________。
-
为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图:
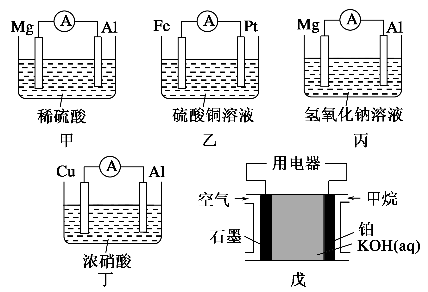
回答下列问题:
(1)根据原电池原理填写下表:
| 装置序号 | 正极 | 负极反应式 | 阳离子移动方向 |
| 甲 | | | |
| 乙 | | | |
| 丙 | | | |
| 丁 | | | |
| 戊 | | | |
(2)电极类型除与电极材料的性质有关外,还与________有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应?_____
(填“是”“否”或“不一定”),请举例说明:__________________________________________。
(4)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲_______,丙_______,戊_______。(填酸性或碱性增强或减弱)
-
某化学兴趣小组在实验室中探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,现象如下:
| 金属 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
下列有关三种金属的说法中,正确的是( )
A. 三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B. 若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C. 用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D. Cu和MgCl2溶液不发生化学反应
-
某化学兴趣小组在实验室中探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,现象如下:
| 金属 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
下列有关三种金属的说法中正确的是( )
A. 三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B. 若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C. 用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D. Cu和MgCl2溶液不发生化学反应
-
某化学兴趣小组在实验室中探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,现象如下:

下列有关三种金属的说法中正确的是( )
A.三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和MgCl2溶液不发生化学反应
-
(10分)某高二化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:

(1)实验①、⑤中Al电极的作用是否相同________(填“是”或“否”);
(2)请在方框内画出实验③的原电池装置图,标出正、负极。

(3)实验②中电流计指针偏向________电极(填“Al”或“Cu”),Cu电极反应式为________;
(4)实验④中铝为________ 极(填“正”或“负”), 其电极反应式为________。
-
某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下。
| 编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“是”或“否”)? _______。
(2)对实验3完成下列填空:
①铝为___极,电极反应式: ______。
②石墨为____极,电极反应式: ________。
③电池总反应式: ____________。
(3)实验4中铝作负极还是正极____,理由是____。写出铝电极的电极反应式: _________。
(4)解释实验5中铝作正极的原因: __________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素: ________。
-
某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下。
| 编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同____________(填“是”或“否”)。
(2)对实验3完成下列填空:
①石墨为________极,电极反应式:__________________________________________。
②电池总反应式:____________________________________________。
(3)实验4中铝作_____极,写出铝电极的电极反应式:________________________。
-
某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下。
| 编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“是”或“否”)?____________。
(2)对实验3完成下列填空:
①铝为________极,电极反应式:__________________________________________;
②石墨为________极,电极反应式:_________________________________________;
③电池总反应式:______________________________________________________。
(3)实验4中铝作负极还是正极________,理由是_________________________________。
(4)解释实验5中电流表指针偏向铝的原因:____________________________________。
写出铝电极的电极反应式:_________________________________________________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:__________________。
-
某实验小组同学对电化学原理进行了一系列探究活动。
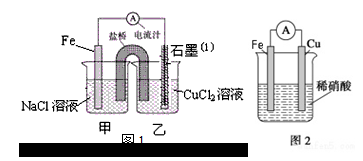
(1)图1为某实验小组依据氧化还原反应: (用离子方程式表示)设计的原电池装置,写出负极的电极反应式 。
(2)盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是 。
A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molFe溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
C.此过程中Cu2+得电子,发生氧化反应
D.电子从铁电极通过导线到石墨电极,又通过盐桥到转移到左烧杯中
(3)反应前,两电极的质量相等,一段时间后,两电极质量相差18g,导线中通过 mol电子。
(4)用吸管吸出铁片附近溶液少许于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(5)若铁和铜构成图2电池,发现铜电极上产生大量气泡,遇空气呈红棕色。写出正极电极反应式: 。