-
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。由方铅矿(主要成分为PbS,含FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如下:
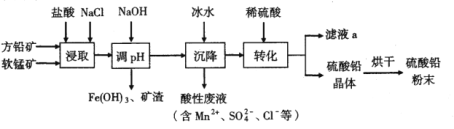
已知:①PbCl2难溶于冷水,易溶于热水
②PbCl2(s)+2Cl-(aq)⇌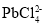 (aq) ΔH>0
(aq) ΔH>0
③Ksp(PbSO4)=1.08×l0-8,Ksp(PbCl2)=1.6×l0-5
(1)“浸取”过程中盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为______;“浸取”时加入饱和NaCl溶液的原因是________。
(2)“调pH”的目的是___________。
(3)“沉降”时加入冰水的作用是__________。
(4)流程中可循环使用的物质是________。
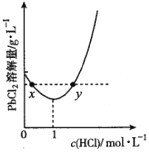
(5)20°C时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g•L-1)如图所示。下列叙述正确的是(填序号)______。
a.盐酸浓度越小,Ksp(PbCl2)越小
b.x、y两点对应的溶液中c(Pb2+)不相等
c.当盐酸浓度为lmol•L-1时,溶液中c(Pb2+)一定最小
-
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:
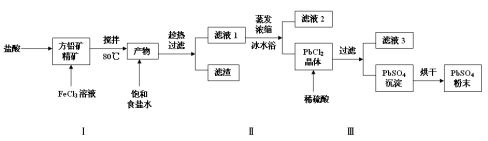
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释加入H2O2后滤液2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
-
硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂.工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:

已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7.
(I)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是 _____________________,反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为 ____________________________;
(II)步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是___________(请用平衡移动原理解释)
(III)上述流程中可循环利用的物质有___________;
(Ⅵ)步骤(4)中反应的离子方程式为_____________________.对滤液C中氯离子的测定可中和后采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。选用K2CrO4溶液的最好浓度等于 _____________mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(Ⅴ)PbO2与MnO2性质相似,请写出PbO2与浓盐酸加热条件下反应的离子方程式______________________
-
用方铅矿精矿( 主要为PbS)和软锰矿(主要为MnO2,还有少量Fe2O3,Al2O3等杂质) 制备PbSO4和Mn3O4的工艺流程如下:
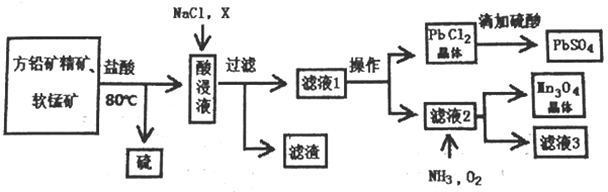
已知:①PbS+MnO2+ 4 H+= Mn2++Pb2++S+2H2O
②25℃ 时,Ksp(PbCl2)=1.6×10-5,Ksp(PbSO4)=1.8×10-8
③PbCl2 (s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是_______________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_________________;加入物质X可用于调节酸浸液的pH值,物质X可以是___________(填字母)。
A.MnCO3 B.NaOH C.ZnO D.PbO
(3)滤渣中含有两种金属杂质形成的化合物,其成分为_____________(写化学式);
请设计分离两种金属化合物的路线图(用化学式表示物质,用箭头表示转化关系,箭头上注明试剂和分离方法)。______________________________________
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式。___________________________________
(5)用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为___________ (填字母)。
A.热还原法 B.电解法 C.热分解法
(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应的平衡常数K=___________(保留到整数位)。
-
方铅矿的主要成分为PbS,含铅可达86.6%。以方铅矿为原料制备铅蓄电池的电极材料PbO2的工艺流程如图所示:
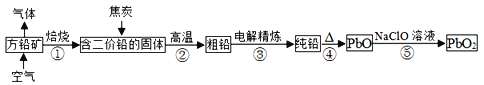
(1)方铅矿焙烧后排出气体的主要成分是______(填化学式),可用于工业制备________。
(2)步骤②中焦炭的作用是________。
(3)“粗铅”的杂质主要有锌、铁、铜、银等。电解精炼时,________作阴极,阴极反应式为________,阳极泥的主要成分是________。
(4)步骤⑤中制备PbO2的离子方程式________。
(5)已知:常温下,Ksp(PbS)=8×10-28、Ka1(H2S)=1.3×10-7、Ka2(H2S)=7.1×10-15。常温下,向Pb(NO3)2溶液中通入H2S气体,发生反应的离子方程式是________;结合数据分析,该反应能否进行得基本完全?________(写出计算推理过程)。
-
软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
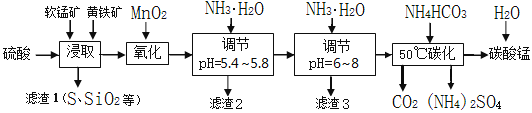
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
| 开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
| 完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。
-
软锰矿的主要成分是MnO2,还含有少量(Hg2+等)重金属化合物杂质。黄铁矿的主要成分是FeS2,还含有SiO2和Al2O3等杂质。工业上采用同槽硫酸酸溶等工艺制备碳酸锰并回收硫酸铵,其主要流程如下:( 已知: Ksp[Al(OH) 3]=1 3×10-33,Ksp[Fe(OH) 3]=5.3×10-38,金属离子的浓度小于1×10-6视为沉淀完全。)
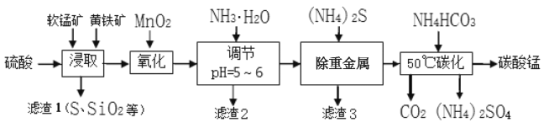
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:
①适当升高温度,②搅拌,③_________________等。
(2)流程“氧化”中加入MnO2与Fe2+发生反应的离子方程式为_________________。
(3)“滤渣2”中主要成分的化学式为_________________。
(4)流程“除重金属”时使用(NH4)2S而不使用Na2S的原因是_________________。
(5)流程“50℃碳化”得到碳酸锰,该反应的化学方程式为_________________。
(6)生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是_________________。
-
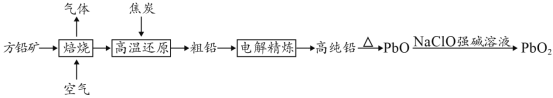
以方铅矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示:
请回答下列问题:
(1)“焙烧”生成的气体直接排放可能造成的环境问题是____________,“焙烧”前须将方铅矿研磨粉粹的目的是________________________________。
(2)电解时,如c(Pb2+)远大于c(H+),则Pb2+优先于H+放电,工业上应用此原理可对铅进行电解精炼。“粗铅”的杂质主要有锌、铁、铜、银等,则阳极泥的主要成分为_________。
(3)写出制备PbO2的离子方程式________________________。
(4)已知部分含铅化合物的Ksp如下表所示:
| 物质 | PbCl2 | PbS |
| Ksp | 1.2×10-5 | 9.0×10-29 |
①铅与稀盐酸反应产生少量气泡后反应终止,原因是_____________________。
②Pb(NO3)2是强酸弱碱盐,氢硫酸是弱酸[Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15],已知K>105时可以认为反应基本完全,通过计算判断向Pb(NO3)2溶液中通入H2S气体能否形成PbS沉淀___________________。(要求写出计算过程)
-
铅蓄电池在现代生活中有广泛的应用。其电极材料是Pb和PbO2,电解质是稀硫酸。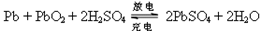 ,下列说法正确的是
,下列说法正确的是
A.铅蓄电池使用一段时间后要添加硫酸
B.电池充电时,阴极反应为:Pb-2e-+SO42- PbSO4
C.电池充电时,电池正极应和电源的正极相连接
D.电池放电时,电池正极周围溶液pH不断增大
-
三氧化二猛(Mn2O3)在现代工业上应用广泛。以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备高纯度硫酸锰进而制备三氧化二锰的工艺流程如下(两种矿物中均不存在单质杂质):
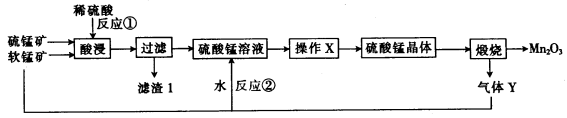
(1)滤渣1中存在一种非金属单质,则“酸浸”时反应①的化学方程式为___________。
(2)操作X为蒸发浓缩、_____________、洗涤烘干。经操作X之后得到MnSO4 • H2O。在洗涤操作中,常用酒精洗涤MnSO4 • H2O晶体,主要目的是_________________。
(3) 气体Y直接排放会污染空气,将Y的水溶液与软锰矿反应可得硫酸锰,反应②的化学方程式为____________。
(4) Mn2O3与MnO2类似,也能与浓盐酸反应,其反应的离子方程式为___________。
(5)用标准的BaCl2溶液测定样品中MnSO4 • H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其原因可能是__________(任写一点)。

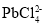 (aq) ΔH>0
(aq) ΔH>0







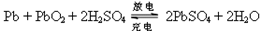 ,下列说法正确的是
,下列说法正确的是