-
(15分)某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收。其工业流程如下:
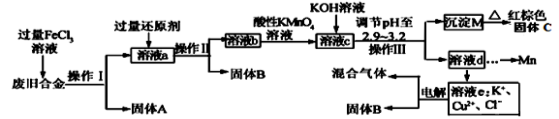
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是 。
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是 ,溶液a中发生的反应的离子方程式为 。
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为 g(用含x、y的代数式表示)。
(4)将溶液c调节pH至2.9-3.2的目的是 。
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至 。
(6)工业上由红棕色固体C制取相应单质常用的方法是 。
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为 。
-
下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
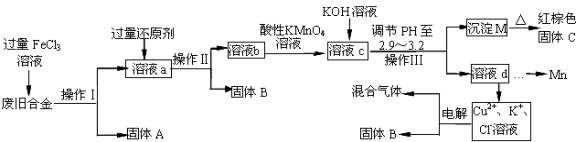
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中与较活泼的金属反应的离子方程式: 。
(3)过量的还原剂应是 ,溶液b中所含的金属阳离子有 。
(4)① 向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
② 若用X mol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液Y mL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: > > 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为m g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L。(用含m的代数式表示)。
-
下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
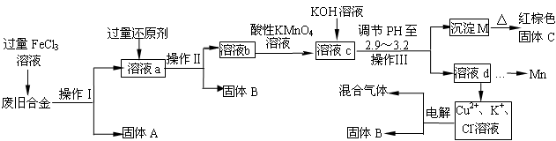
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式: 。
(3)过量的还原剂应是 ,溶液b中所含的金属阳离子有 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用Xmol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: > > 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Zg,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示)。
-
某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收.其工业流程如图:
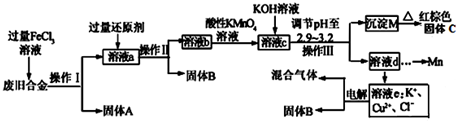
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是________,溶液a中发生的反应的离子方程式为________;
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为________g(用含x、y的代数式表示).
(4)将溶液c调节pH至2.9-3.2的目的是________;
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至________;
(6)工业上由红棕色固体C制取相应单质常用的方法是________
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为________。
-
下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
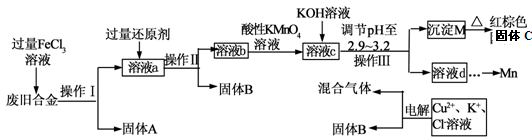
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式: 。
(3)过量的还原剂应是 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示);该电极的反应式为 .
-
下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
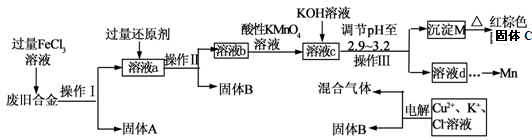
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式: 。
(3)过量的还原剂应是 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示);该电极的反应式为 .
-
化学选修:化学与技术某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收.其工业流程如图:
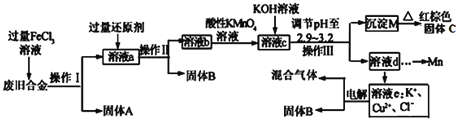
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是________,溶液a中发生的反应的离子方程式为________;
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为________g(用含x、y的代数式表示).
(4)将溶液c调节pH至2.9-3.2的目的是________;
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至________;
(6)工业上由红棕色固体C制取相应单质常用的方法是________
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为________。
-
某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收。其工业流程如图所示:
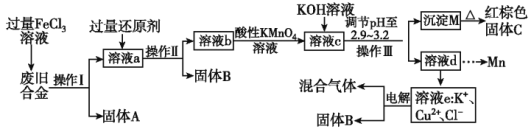
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是_______。
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是______,溶液a中发生的反应的离子方程式为_______。
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液y mL,则最后所得红棕色固体C的质量为_______g(用含x、y的代数式表示)。
(4)将溶液c调节pH至2.9~3.2的目的是_________________________________________。
(5)工业上由红棕色固体C制取相应单质常用的反应方程式为___________________。
-
如图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si三种成分)进行分离、回收再利用的工业流程,通过该流程能得到常用的单质、聚铁(碱式硫酸铁的聚合物)、铁红(Fe2O3)和绿矾(FeSO4·7H2O)。
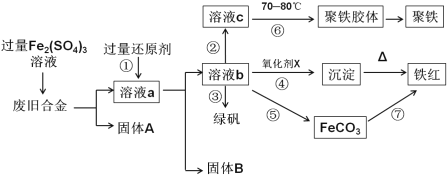
(1)①中过量的还原剂应是____________________。
(2) 向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_______________________。
(3)②中加入H2O2,并调节pH值得到溶液c,在⑥中,将溶液c控制到70-80℃的目的是________。
(4)在③中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有_________________________。
(5)在④中的氧化剂X是________________________。
(6)在⑤中,向溶液b加入了NH4HCO3溶液,得到FeCO3沉淀,写出离子反应方程式 ______________。
-
下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程能得到常用的单质、聚铁(碱式硫酸铁的聚合物)、铁红(Fe2O3)和绿矾(FeSO4·7H2O)。
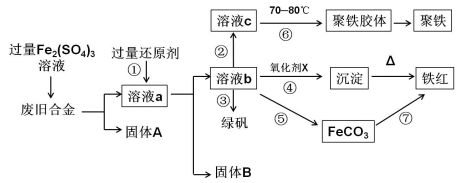
(1)加入过量Fe2(SO4)3溶液过程中与较活泼的金属反应的离子方程式: 。
(2)①中过量的还原剂应是 ,固体B是 。
(3)向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
(4)②中加入H2O2,并调节pH值得到溶液c,在⑥中,将溶液c控制到70~80 ℃的目的是 。
(5)在③中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有 。
(6)在④中的氧化剂X是 。
(7)在⑤中,向溶液b加入了NH4HCO3溶液,得到FeCO3沉淀,写出其离子反应方程式: 。
(8)在⑦中,写出FeCO3煅烧的化学反应方程式: 。









