-
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下:
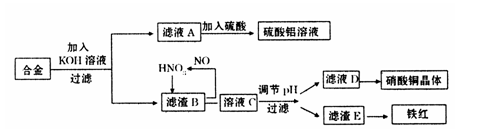
(1)请写出在合金中加入KOH溶液后所发生的离子反应方程式:
________ 。
(2)在滤液A中直接加入硫酸所获得的硫酸铝溶液中会含有杂质(K2SO4),请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液。仿照上图形式画出制备流程图:(提示:在箭头上下方标出所用试剂或实验操作)
(3)已知Fe(OH)3沉淀的pH是2~3.2。溶液C通过调节pH可以使Fe3+沉淀完全。下列物
质中,可用作调整溶液C的pH的试剂是(填序号)
A. 铜粉 B.氨水 C. 氧化铜 D.氢氧化铜
(4)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热蒸发、冷却结晶、
________ (填操作名称)、自然干燥。
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol·L-1,c(H2SO4)=3mol·L-1。将0.3mol的铜放入并充分反应后,产生的铜盐的化学式是________,被还原的n(HNO3)=________。
-
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:
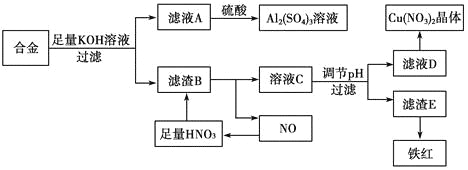
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________,此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________。
-
I.垃圾是放错地方的资源,工业废料也可以再利用,某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液,硝酸铜晶体和铁红(Fe2O3)。实验方案如下:
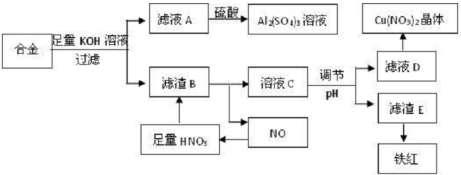
(1)已知Fe(OH)3沉淀的pH范围是3-4,溶液C通过调节pH可以使Fe3+沉淀完全,下列物质中可用作调整溶液C的pH的试剂是______________(填序号)
A.铜粉 B.氨水 C.氢氧化铜 D.碱式碳酸铜
(2)常温下,若溶液C中金属离子均为1mol/L,Ksp[Fe(OH)3]=1.0×10-39,Ksp[Cu(OH)2]=2.2×10-20,控制pH=4,溶液中c(Fe3+)=______________,此时______________(填“有” 或“无”)Cu(OH)2沉淀生成。
(3)将20mLAl2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,反应的离子方程式为______________。
Ⅱ.工业上以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定晶体中,MgSO4的含量,具体过程如下:
将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH值,静置后过滤,除去滤渣将滤液结晶得硫酸镁晶体。
(1)加入H2O2的目的是______________(用离子方程式解释)
(2)常采用下列方法测定硫酸镁晶体中MgSO4 的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2+)原形成配合物。
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来:Zn2++MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.5g加入过量的EDTA配成100mLpH 在9~10之间溶液A
步骤2:准确移取25.00mL:溶液A于锥形瓶中,用0.1000mol/LZn2+标准溶液滴定,滴定到终点时,消耗Zn2+标准溶液的体积为20.00mL
步骤3:另外准确移取25.00mL溶液A于另一只锥形瓶中调节pH在5~6,用0.1000mol/LZn2+标准溶液滴定,滴定至终点时,消耗Zn2+标准溶液的体积为30.00mL。
计算该晶体中MgSO4的质量分数为______________。
-
某化学兴 趣小组的同学
趣小组的同学 在实验室中用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其实验流程如下图所示。
在实验室中用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其实验流程如下图所示。
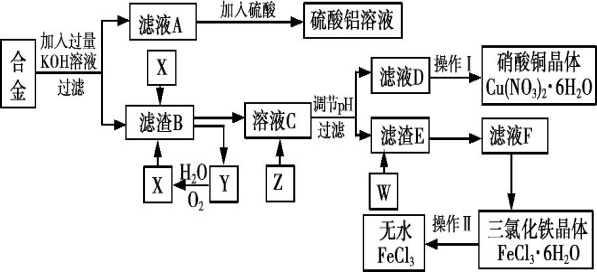
已知:Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7 ~6.7。
~6.7。
请回答下列问题:
(1)写出向合金中加入KOH溶液后所发生反应的离子方程式:__________________,若在该反应中转移0.6NA的电子,则获得标准状况下的气体体积为________L。
(2)下列物质中可作为试剂Z的是_______(填序号)。
A.铜粉 B.氨水 C.氧化铜
加入Z后,调节溶液的pH范围应为________________。
(3)实验操作Ⅰ的顺序依次为____________(填序号)。
A.蒸发浓缩 B.过滤 C.冷却结晶
(4)写出滤渣E与W反应的化学方程式______________________。
-
某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体和胆矾晶体.其实验方案如下:
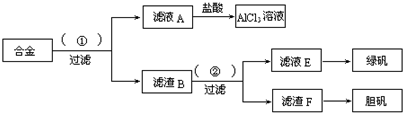
(1)所加试剂①、②分别是______、______.
(2)从滤液E中得到绿矾晶体的实验操作是______;从滤渣F制取胆矾的第一步操作最好采用______.
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由______、______.
你认为正确的设计方案是______.
-
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(七水合硫酸亚铁)和胆矾晶体,以探索工业废料的再利用.其实验方案如下:试回答下列问题:
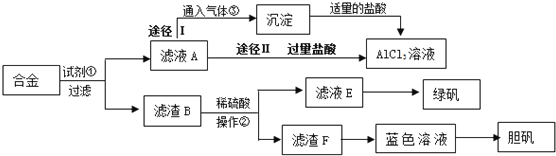
(1)写出合金溶于试剂①溶液时相关反应的离子方程式 ____________________________,操作②的名称是 ______________ 。
(2)滤液A中通入过量气体的离子反应方程式为_______________________________,由滤液A制AlCl3溶液有途径I和途径II两种,与途径I相比,途径II存在着明显的缺陷是: _________________________________________________________。
(3)溶液E中的主要溶质为 _____________________ ;如何检验滤液E是否已被氧化(写出操作过程、现象和结论) _______________________________________________。
(4)按环保要求,写出用滤渣F制备硫酸铜溶液的各步反应的化学方程式 ________。
-
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
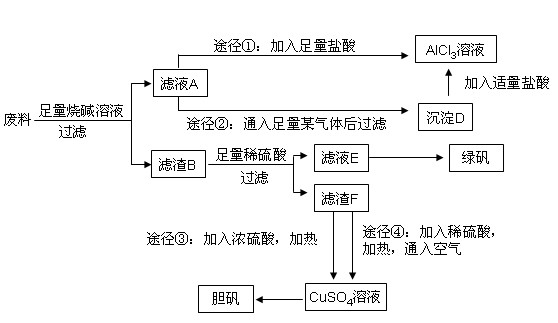
(1)写出合金与烧碱溶液反应的离子方程式:。
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体(固态时可用于人工降雨),写出该气体的电子式________。你认为较合理的途径是________(填①或②),理由是:________。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了 和
和 外,还可能存在________(用离子符号表示),检测该离子的方法是________。
外,还可能存在________(用离子符号表示),检测该离子的方法是________。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是:________、________。
(5)途径④发生的反应的化学方程式为:________。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、、自然干燥。
-
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体[FeSO4•7H2O]和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
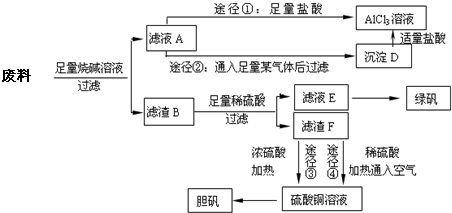
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式______.
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体其固态可用于人工降雨,则该气体是______(填化学式),滤液A与过量的某气体生成沉淀D的离子方程式为______.你认为较合理的途径是______(填①或②),理由是______.
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了Fe2+和H+外,还最可能存在的阳离子是______(用离子符号表示),检测该离子的方法是______.
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是______、______.
(5)途径③发生的反应中,体现了浓硫酸______性和______性.通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、______、自然干燥.其中途径④发生的反应为______(用一个离子方程式表示).
-
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
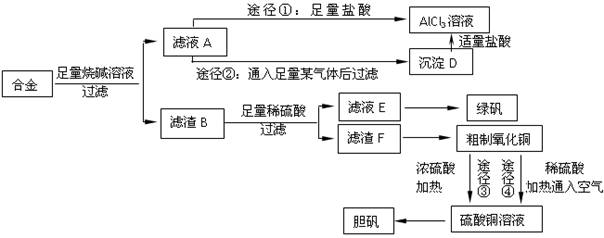
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式,有人认为合金与烧碱溶液形成了原电池,则作为原电池负极的物质是________。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为合理的是________________。上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有________和玻璃棒;其中玻璃棒的作用是________。
(3)用粗制氧化铜通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是: 、________ 。
(4)通过途径④实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、________、自然干燥。其中“加热通氧气”所起的作用为________(用离子方程式表示)。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行________次。若测定结果x值偏高,可能的原因是________。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
e.加热时胆矾晶体飞溅出来 f.所用坩埚事先未干燥(潮湿)
-
(18分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[FeSO4·7H2O]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
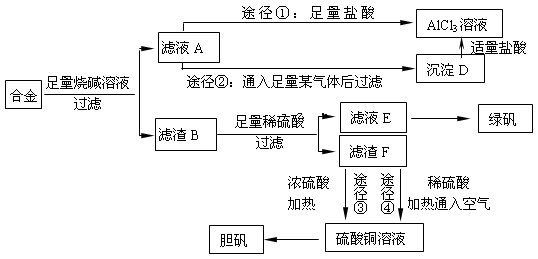
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式________。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为合理的是________________。上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有和玻璃棒;其中玻璃棒的作用是________。
(3)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是________ 、 。
(4)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、 ________、冷却结晶、________、自然干燥。其中“加热通氧气”所起的作用为(用离子方程式表示)。
 (5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO4·xH2O===CuSO4+xH2O ,但温度过高,CuSO4会继续分解为CuO和SO3。在此实验过程中,称量操作至少进行次。若测定结果x值偏高,可能的原因是________。
(5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO4·xH2O===CuSO4+xH2O ,但温度过高,CuSO4会继续分解为CuO和SO3。在此实验过程中,称量操作至少进行次。若测定结果x值偏高,可能的原因是________。
a.加热温度过高 b.加热时胆矾晶体飞溅出来
c.加热后放在空气中冷却 d.所用坩埚事先未干燥(潮湿)










