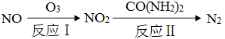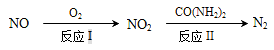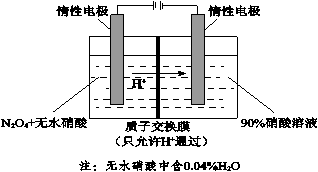-
(15分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下: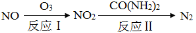
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
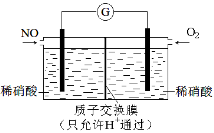
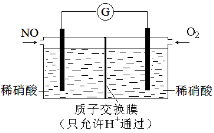
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。

(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
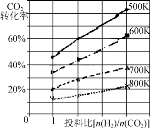
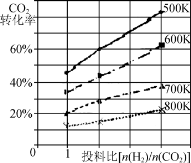
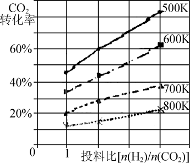
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。
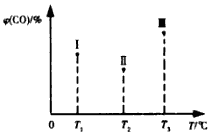
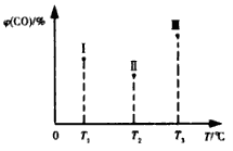
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
-
(16分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化还原法消除氮氧化物的转化如下:
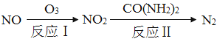
①反应I为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应II中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1。
2SO3(g) △H=-196.6 kJ·mol-1。
写出NO和O2反应生成NO2的热化学方程 式 。
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);该反应 平衡常数表达式为K= 。
CH3OCH3(g)+3H2O(g);该反应 平衡常数表达式为K= 。
(4)合成气CO和H2在一定条件下能发生如下反应:
CO(g) +2H2(g) CH3OH(g) △H<0。
CH3OH(g) △H<0。
在容积均为V L的I、II、III三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数υ(CO)%如图所示,
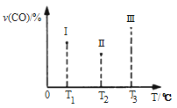
此时I、II、III三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应再经过一段时间后都达到化学平衡时,CO转化率最大的反应温度是 。
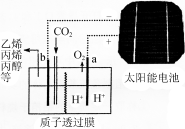
(5)据报道以二氧化碳为原料,采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如下图所示。电解时,b极上生成乙烯的电极反应式为___________________.
-
(15分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化: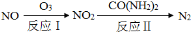
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
-
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化: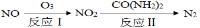
反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
 (2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) ΔH=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
该反应平衡常数表达式为K= 。
已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“大于”、“小于”或“等于”)0。
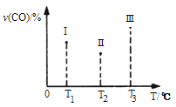
(4)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) ΔH<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) ΔH<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
-
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)二氧化碳能引起温室效应,而对二氧化碳的捕集、利用是当今世界能源领域的一个重要研究方向。工业上用CO2和H2在一定条件下反应可合成二甲醚,已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g);△H1=-53.7kJ/mol
CH3OCH3(g)+H2O(g)═2CH3OH(g);△H2=+23.4kJ/mol
则2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);△H3=________kJ/mol
CH3OCH3(g)+3H2O(g);△H3=________kJ/mol
(2)在一定条件下CO2和H2充入一定固定容积的密闭容器中,在两种不同温度下发生反应:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图1所示。
CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图1所示。
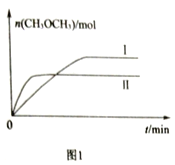
①曲线I、Ⅱ对应的平衡常数大小关系为KI________KⅡ(填“>”或“=”或“<”)。
②一定温度下,若此反应在恒压容器中进行,不能判断该反应达到化学平衡状态依据的是______。
a.混合气体的密度 b.CH3OCH3(g)和H2O(g)体积比不变
c.c(H2)=2c(H2O) d.4个C=O断裂的同时有6个H-O断裂
③一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填代号)。
A.CO2的转化率增大 B.逆反应速率先增大后减小
C.容器中的 值变大 D.平衡常数增大
值变大 D.平衡常数增大
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g) CH3OH(g);△H。
CH3OH(g);△H。
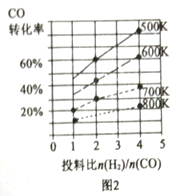
①在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图2所示。500K温度下,将2molCO和4molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OH)=________。
②△H________0(填“>”或“=”或“<”)。
③上述合成甲醇的过程中提高CO的转化率可采取的措施有________、________(回答2点)。
-
(16分)NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)氮氧化物产生的环境问题有 (填一种)。
(2)氧化—还原法消除氮氧化物的转化如下:

①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
①已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
写出NO和O2反应生成NO2的热化学方程式 。
②一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3∶1,则NO2的平衡转化率是 。
③上述反应达平衡后,其它条件不变时,再往容器中同时充入
NO2、SO2、SO3、NO各1mol,平衡 (填序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料。则负极的电极反应式是 。

-
(16分)NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)氮氧化物产生的环境问题有 (填一种)。
(2)氧化—还原法消除氮氧化物的转化如下: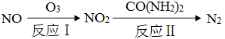
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
①已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
写出NO和O2反应生成NO2的热化学方程式 。
②一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3∶1,则NO2的平衡转化率是 。
③上述反应达平衡后,其它条件不变时,再往容器中同时充入
NO2、SO2、SO3、NO各1mol,平衡 (填序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料。则负极的电极反应式是 。

-
生产生活中的化学电源、金属冶炼、环境污染等都与氧化还原反应息息相关,研究氧化还原反应,对人类进步和社会发展都具有极其重要的意义。
(1)已知下列反应在一定条件下可以发生:H2O2+2Fe2++2H+=2Fe3++2H2O;H2O2+2Fe3+= 2Fe2++2H+ +O2↑
①通过观察以上两个反应,对其中Fe2+的认识是 __________________。
②I2和Fe2+一样也能与H2O2发生上述类似反应,类比上述反应,在下面空格上填入合适的化学方程式:H2O2+I2= 2HIO;___________。总的化学方程式为_____________________________。
(2)2017年4月1日,中共中央、国务院印发通知,决定设立河北雄安新区。据报道周边污水渗坑给雄安新区的水环境带来隐患,目前采用多种方法对污水进行处理,改善水资源状况。
①碱性环境下,Cl2可将水中残存的CN-转化为两种无毒的气体,则该反应生成两种无毒气体的物质的量之比为_________________。
②酸性环境下,向含重铬酸根(Cr2O72-)的废水中加入FeSO4溶液,然后调节溶液pH,使生成的Cr3+转化为Cr(OH)3,写出第一步反应对应的离子方程式________________________________。
-
化学与人类生活、社会可持续发展密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生
C.研发高效低毒的农药,降低蔬菜的农药残留量
D.积极开发废电池的综合利用技术,防止电池中的重金属等污染土壤和水体
-
氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义。
(1)NO可通过氧化-还原法转化为N2,转化关系如下:
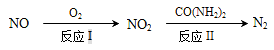
反应Ⅰ的化学方程式是_______;反应Ⅱ的还原剂是_______。
(2)NO还可与C在一定条件下反应得到无污染的气 体。NO与C在一定条件下反应的化学方程式是_______。
体。NO与C在一定条件下反应的化学方程式是_______。
(3)NO也可直接用活性铁粉转化为N2。
已知:N2(g)+O2(g)=2NO(g) △H1
4Fe(s)+3O2(g)=2Fe2O3(s) △H2
则6NO(g)+4Fe(s)=2Fe2O3(s)+3N2(g) △H =___________(用“△H1”、“△H2”表示)。
(4)NO2可电解制备绿色硝化试剂N2O5。下图是其原理示意图。
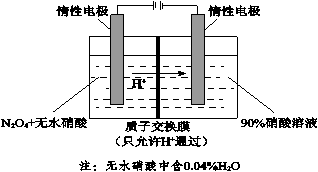
① 阳极电解液中的N2O4由NO2降温转化得到,降温的原因是_______________。
② 阳极区生成N2O5的电极反应式是_______________。
③ 阴极区得到一种可循环利用的物质,其化学式是_______________。
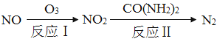
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1。
CH3OCH3(g)+3H2O(g);该反应 平衡常数表达式为K= 。
CH3OH(g) △H<0。


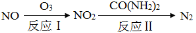



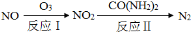



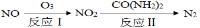
 (2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)