-
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下:
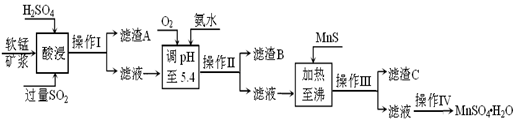
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为________ ________。
酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 ________ 。
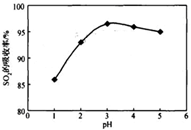
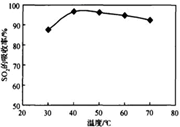
图1: SO2 的吸收率与 pH值的关系 图2: SO2的吸收率与温度的关系
(2)滤渣B的主要成分是________ ________。
(3)加入MnS的目的是________ ________ ________。
(4)操作IV的步骤为 、 、过滤、洗涤、干燥。
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: ________ 。
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为________(不需计算过程,计算结果保留两位有效数字)。
-
工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。

回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的离子方程式为 。
(2)调节pH时不用氢氧化钠原因是: ,理论上,调节pH的最小值为 ,滤渣B的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。回收废旧碱性锰电池中的锰,可向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnO(OH)+MnO2 +2H2C2O4 +3H2SO4=3MnSO4 +4CO2 ↑+6H2O,该方法的优点是 。
-
二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
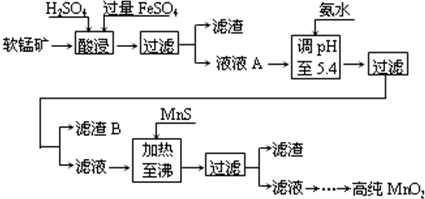
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Pb(OH)2 | Mn(OH)2 | PbS | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 8.7 | 10.4 | ≥0.1 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______.
(2)滤渣B的主要成分是______.
(3)加入MnS的目的是除去______杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为______.
-
(14分)工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂废气SO2,并制备MnSO4.H2O晶体,其工艺流程如下:
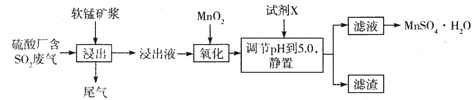
已知:①浸出液的pH<2,且阳离子主要是Mn2+,以及少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:

请回答下列问题:
(1)浸出液pH <2的原因可能是_________________________________________。
(2)加入MnO2,氧化时溶液中反应的离子方程式为________________________ ,若流程中取消“加入MnO2”,对上述流程的影响是________________________________________。
(3)试剂X________(填“能”或“不能”)选用氢氧化锰,试说明理由:____________
______________________________________________________________________________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是______________________
______________________________________________________________________________。
(5)从滤液中提取MnSO4.H2O晶体的操作是____________________________________。
-
工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下:
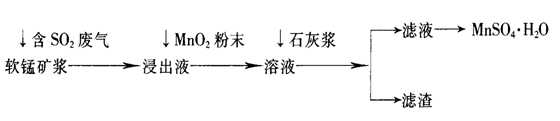
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)软锰矿浆中通入含SO2废气后,发生主要反应的化学方程式为____________________。
(2)浸出液中加入MnO2粉末的目的是____________;反应的离子方程式是___________________。
(3)溶液中加入石灰浆来调节pH,其作用是_________________;pH应调节的范围是__________。
(4)滤渣的主要成分是________________________________________________(用化学式表示)。
-
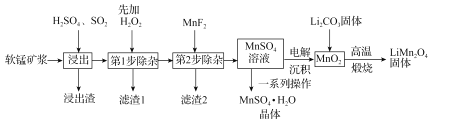
锰酸锂(LiMn2O4)是新型锂离子电池常用的正极材料。工业上以软锰矿浆为原料可制备锰酸锂,同时制得副产品MnSO4·H2O晶体,其流程如图所示。
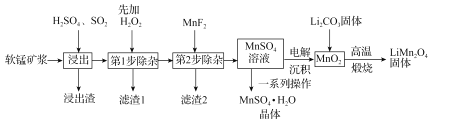
已知:(1)软锰矿浆的主要成分为MnO2,还含有Fe2O3,MgO、Al2O3,CaO,SiO2等杂质。
(2)温度高于27℃时,MnSO4晶体的溶解度随温度升高而逐渐降低。
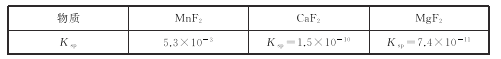
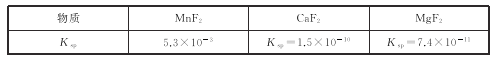
(3)有关物质的溶度积常数如下表:
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为_____。该过程中,为提高软锰矿中MnO2的浸出率,下列措施可行的有_____(填字母)。
A.不断搅拌,使SO2和软锰矿浆充分接触
B.增大通入SO2的流速
C.适当升温
D.减少软锰矿浆的进入量
(2)第1步除杂中加入H2O2的目的是_____。
(3)第2步除杂,主要是将Ca2+,Mg2+转化为相应的氟化物沉淀除去,其中MnF2除去Mg2+反应的离子方程式为MnF2(s)+Mg2+(aq)=Mn2+(aq)+MgF2(s),该反应的平衡常数为_____。
(4)图中的一系列操作指的是_____。
(5)将MnO2和Li2CO3按4:1的物质的量之比配料,混合搅拌,然后高温煅烧600~750℃,制取产品LiMn2O4。写出该反应的化学方程式:_____。
-
锰酸锂(LiMn2O4)是新型锂离子电池常用的正极材料。工业上以软锰矿浆为原料可制备锰酸锂,同时制得副产品MnSO4·H2O晶体,其流程如图所示。
已知:(1)软锰矿浆的主要成分为MnO2,还含有Fe2O3,MgO、Al2O3,CaO,SiO2等杂质。
(2)温度高于27℃时,MnSO4晶体的溶解度随温度升高而逐渐降低。
(3)有关物质的溶度积常数如下表:
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为_____。该过程中,为提高软锰矿中MnO2的浸出率,下列措施可行的有_____(填字母)。
A.不断搅拌,使SO2和软锰矿浆充分接触
B.增大通入SO2的流速
C.适当升温
D.减少软锰矿浆的进入量
(2)第1步除杂中加入H2O2的目的是_____。
(3)第2步除杂,主要是将Ca2+,Mg2+转化为相应的氟化物沉淀除去,其中MnF2除去Mg2+反应的离子方程式为MnF2(s)+Mg2+(aq)=Mn2+(aq)+MgF2(s),该反应的平衡常数为_____。
(4)图中的一系列操作指的是_____。
(5)将MnO2和Li2CO3按4:1的物质的量之比配料,混合搅拌,然后高温煅烧600~750℃,制取产品LiMn2O4。写出该反应的化学方程式:_____。
-
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
(1)纯度为75%的软锰矿17.40g最多能氧化 L(标准状况)SO2.
(2)已知:Ksp[Al(OH)3]=1×10﹣33,Ksp[Fe(OH)3]=3×10﹣39,pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol•L﹣1),需调节溶液pH范围为 .
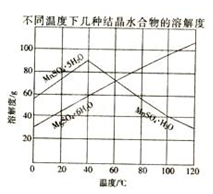
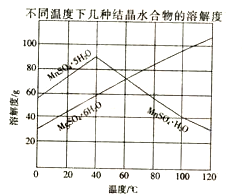
(3)如图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4•H2O晶体,需控制结晶温度范围为 .
(4)准确称取0.1800gMnSO4•H2O样品置于锥形瓶中,加入适量H2PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500mol•L﹣1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL.计算MnSO4•H2O样品的纯度为 %(结果保留两位有效数字)
(5)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。用软锰矿制备K2MnO4的化学方程式是: 。
(6)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
-
(12分)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O ,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.40g纯净MnO2最多能氧化_____L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为________。
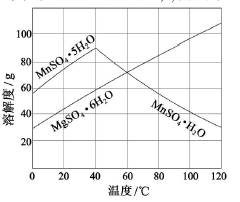
(3)右图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需
控制结晶温度范围为_______。
(4)准确称取0.1710gMnSO4·H2O样品置于锥形瓶中,加入适量H2PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL。计算MnSO4·H2O样品的纯度(请给出计算过程)
-
(12分) 软锰矿(主要成分MnO2,含Fe,Al2O3 ,MgO杂质)的水悬浊液与烟气中的SO2反应可制备MnSO4·H2O,MnO2与SO2反应的化学方程式为MnO2 +SO2=MnSO4。已知下列信息:
室温下几种氢氧化物的溶度积

回答下列问题:
(1)质量为17.40 g纯净MnO2最多能氧化 L(标准状况) SO2。
(2)悬浊液吸收烟气后,Fe首先转化为Fe2+进入溶液,然后被 氧化为Fe3+;要证明溶液中存在Fe3+,可选择的试剂是 (填标号)。
a.KMnO4溶液 b.KCl溶液 c.KSCN溶液 d.KNO3溶液
(3)室温下,将吸收液过滤,在滤液中加入CaCO3,可除去MnSO4溶液中的Fe3+、Al3+,原因是 。
(4)从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为 。
















