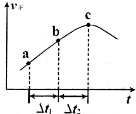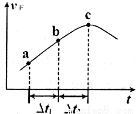-
合成氨工业是工农业生产和国防工业的基础产业,也是国民经济的命脉产业。其原理如下:N2(g)+3H2(g)⇌2NH3(g)△H〈 0 。

(1)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如图1所示。
① 表示H2浓度变化的曲线是 (填序号)。
② 前25min 内,用NH3浓度变化表示的化学反应速率是 。
(2)某学习小组研究:在其他条件不变的情况下,研究改变起始物氢气的物质的量对该合成氨反应的影响.实验结果如图2所示:(图中T表示温度,n表示物质的量)
①比较T1 T2 (填“>”,“<”, “=”)。
②比较在a、b、c三点N2的转化率最高的是 ;H2的百分含量最高的是 (填字母)。
③在起始体系中加入N2的物质的量为 mol时(用含n的代数式表示),反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则在T2条件下,该反应的平衡常数K= 。(保留3位有效数字)
-
化肥是农业生产最基础而且是最重要的物质投入.工业上利用N2和H2合成氨,其化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H<0
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1________573K(填“>”、“<”或“=”).
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(2)将一定量的N2和H2的混合气放入某密闭容器中发生上述反应.
①下列措施中可提高氢气的转化率的有________(填字母).
A.升高温度 B.使用催化剂
C.增大压强 D.循环利用和不断补充氮气
②在一定温度和压强下,将H2和N2按体积比3:1在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数为 ,此时N2的转化率为________.
,此时N2的转化率为________.
(3)某厂每天产生600m3含氨废水.该厂处理废水的方法:将废水加热得到NH3,使废水中NH3的浓度降为17mg•L-1.再对加热蒸发得到的NH3用一定量空气氧化.发生的主反应如下:
4NH3+5O2 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3
副反应为:4NH3+3O2=2N2+6H2O
①该厂每天通过加热蒸发可得到NH3的物质的量是多少?
②若氧化过程中90% NH3转化为硝酸,10% NH3发生了副反应,则该厂每天消耗标准状况下的空气多少立方米?(假设废水加热前后的体积和密度近似认为不变,空气中氧气的体积分数20%.)
-
(14分)合成氨对工、农业生产和国防都有重要意义。
已知:N2(g)+3H2(g) 2NH3(g);△H= -92.4 kJ·mol-1,请回答:
2NH3(g);△H= -92.4 kJ·mol-1,请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是_____(填字母)。
a.用铁触媒(催化剂)加快化学反应速率
b.采用较高压强(20 MPa~50 MPa)
c.将原料气中的少量CO等气体净化除去
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积V恒定,达到平衡时,气体的压强为原来的 ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2__а1(填“>、<或=”)。
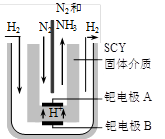
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。钯电极A是电解池的____极(填“阳”或 “阴”),该极上的电极反应式是________。
-
(14分)化学反应原理在科研和工农业生产中有广泛应用。
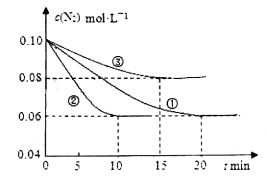
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)  2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
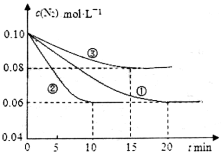
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
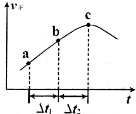
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
-
化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g)
2NH3(g)  。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间
。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间 的变化如下图所示:
的变化如下图所示:
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=_______________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
a.增大压强 b.减小压强 c.升高温度 d.降低温度 e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol·L ,则该反应的平衡常数K=_______________;
,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
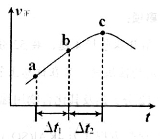
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C. 时,NO2的转化率:a~b段小于 b~c段
时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol·L 的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3
的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数
H2O的电离平衡常数 =___________。
=___________。
-
化学反应原理在科研和工农业生产中有广泛应用。
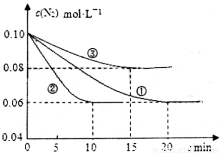
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
在l L密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=____________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的___________、_________(填字母编号)。
A增大压强 B减小压强 C升高温度 D降低温度 E使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_____________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将__________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
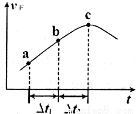
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将a mol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a__b。(填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
-
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:
N2(g)+3H2(g)⇌2NH3(g) △H=-92.4KJ/mol,
(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如下表:
| 不同时间各物质的物质的量/mol |
| 0min | 1min | 2min | 3min | 4min |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
| | | | | |
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_____________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向___________(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是__________(选填序号)
A.N2的转化率等于NH3的产率
B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变
D.混合气体的密度不变
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是__________。
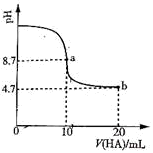
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)= c(A-)+ c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L
-
氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+3H2(g) 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
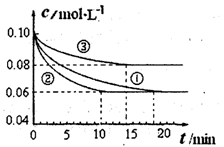
实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为________。与实验①相比,.实验②所采用的实验条件可能为________(填字母),实验③所采用的实验条件可能为________(填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是________(填字母)
2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是________(填字母)
a.升高温度 b.增大压强 c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到________(填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为________。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a________b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为________。
-
氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+3H2(g) 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
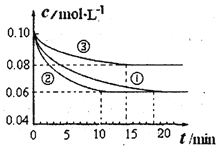
实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为 。与实验①相比,.实验②所采用的实验条件可能为 (填字母),实验③所采用的实验条件可能为 (填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
a.升高温度 b.增大压强 c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到 (填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为 。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为 。
-
合成氨工业对国民经济和社会发展具有重要的意义。 合成塔中发生反应为: N2(g)+3H2(g)  2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)  CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,
体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K =________。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,
水蒸气的总转化率α (H2O)________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1 573K(填“>”、“<”或“=”)。
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)________。
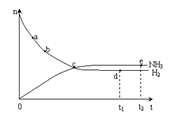
A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是 ________
。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
________。