-
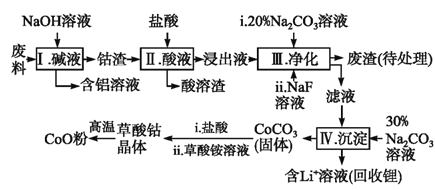
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
已知:①物质溶解性:LiF难溶于水,CoCO3难溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)Ⅰ中得到钴渣的实验操作是 (填操作名称)。
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: .
(4)步骤Ⅲ中调节溶液的pH时, pH的范围是 。
(5)废渣中的主要成分有 .
(6)在空气中加热10.98g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 8.82 |
| 290~320 | 4.82 |
| 890~920 | 4.5 |
②加热到210℃时,固体物质的化学式为: .
③经测定,加热到210~310℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为: ..
-
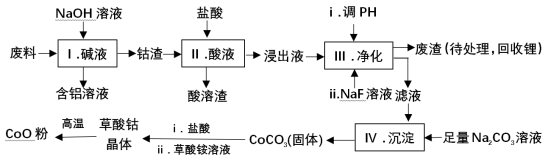
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
已知:①物质溶解性:LiF难溶于水,CoCO3难溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)Ⅰ中得到钴渣的实验操作是 (填操作名称)。
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: .
(4)步骤Ⅲ中调节溶液的pH时, pH的范围是 。
(5)废渣中的主要成分有 .
(6)在空气中加热10.98g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 8.82 |
| 290~320 | 4.82 |
| 890~920 | 4.5 |
②加热到210℃时,固体物质的化学式为: .
③经测定,加热到210~310℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为: ..
-
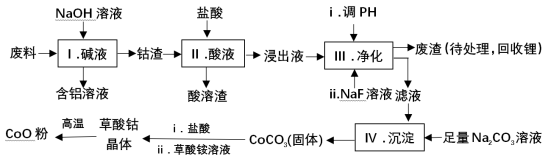
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
已知:①物质溶解性:LiF难溶于水,CoCO3难溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
| | Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)Ⅰ中得到钴渣的实验操作是 (填操作名称)。
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: .
(4)步骤Ⅲ中调节溶液的pH时, pH的范围是 。
(5)废渣中的主要成分有 .
(6)在空气中加热10.98g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 8.82 |
| 290~320 | 4.82 |
| 890~920 | 4.5 |
②加热到210℃时,固体物质的化学式为: .
③经测定,加热到210~310℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为: ..
-
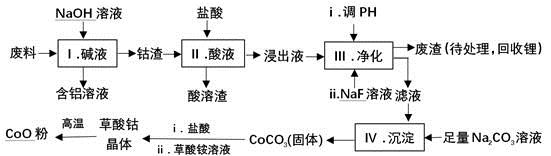
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
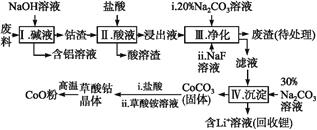
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表。
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是__________。
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过______;废渣中的主要成分除了LiF外,还有______。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是______。
(5)在空气中加热5.49 g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
①加热到210 ℃时,固体质量减轻的原因是__________。
②经测定,加热到210~290 ℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为___________。[已知M(CoC2O4·2H2O)=183 g·mol-1]
-
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
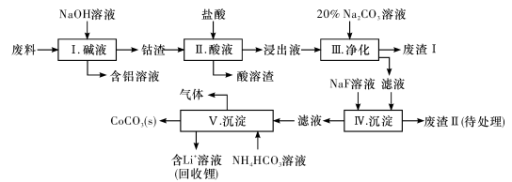
已知:①物质溶解性:LiF、CoCO3难溶于水,Li2CO3微溶于水;
② Co2O3有强氧化性,能氧化盐酸;
③ 部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1) 步骤I中得到含铝溶液的反应的离子方程式是________________。
(2) 步骤D中加人盐酸的作用是________________。
(3) 步骤III中Na2CO3溶液的作用是调节溶液的PH,应使溶液的pH控制在_____(填范围),废渣I中的成分有________________。
(4) 步骤V中产生CoCO3的离子方程式是________________。
(5) 滤渣II用硫酸处理后用三室式电渗析法电解可得LiOH溶液和稀硫酸。则离子交换膜c为__________(填“阴”或“阳”)离子交换膜,随着电解的进行,阴极区pH将_________(填“增大”、“减小”或“不变”)。
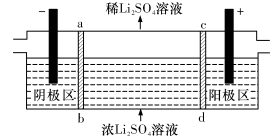
(6) 向所得LiOH溶液中加入NH4HCO3即可得到Li2CO3。工业上以碳酸锂和碳酸钴在空气中高温煅烧制备锂离子电池的正极材料钴酸锂 (LiCoO2)时,还会产生一种三原子构成的直线型气体分子,该分子的电子式为_______________,写出工业上用上述方法制备钴酸锂的化学反应方程式___________________。
(7) 某锂离子充电时电池的总反应为C6+ LiCoO2==LixC6+Li1-xCoO2,该锂离子电池放电时正极的电极反应式为__________________。
-
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
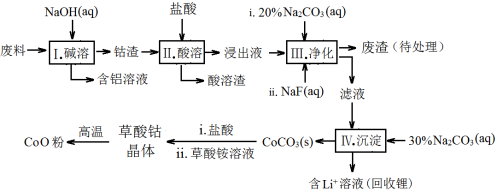
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式 。
(2)步骤Ⅱ中Co2O3与盐酸反应的离子方程式 。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应调节溶液的pH范围是 ;废渣中的主要成分为 。
(4)步骤Ⅲ中NaF参与的反应对步骤Ⅳ所起的作用是
(5)在空气中加热5.49 g草酸钴晶体(CoC2O4·2H2O)样品,[ M (CoC2O4·2H2O) = 183 g/mol ] 受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
| 温度范围/℃ | 固体质量/ g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是
-
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
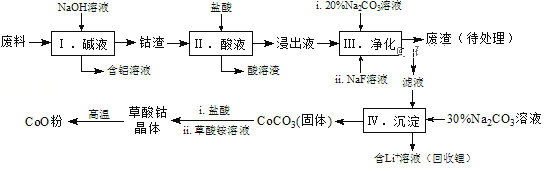
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是______.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过______;废渣中的主要成分除了LiF外,还有______.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是______.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
①加热到210℃时,固体质量减轻的原因是______.
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:____.
-
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
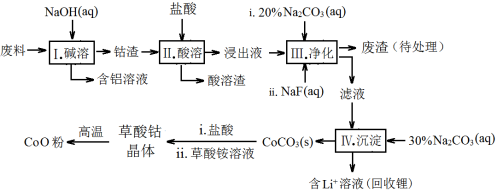
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式 。有同学认为Ⅱ中将盐酸换成硫酸和H2O2溶液更好,请结合离子方程式说明理由 。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过__________。废渣中的成分有_________________。
(4)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二元化合物,该化合物中钴元素的质量分数为73.44%。此过程发生反应的化学方程式是_______________。
(5)某锂离子电池的总反应为C6+LiCoO2  LixC6+Li1-xCoO2,LixC6中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为 。
LixC6+Li1-xCoO2,LixC6中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为 。
-
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
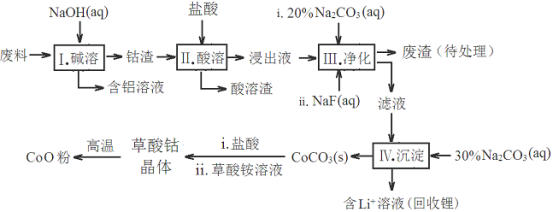
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是____________________________。
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式_________________________
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过__________。废渣中的成分有______________________。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___________。
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二化合物,该化合物中钴元素的质量分数为73.44%。此过程发生反应的化学方程式是_________________。
(6)某锂离子电池的总反应为C+LiCoO2 LixC+Li1-xCoO2,LixC中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为______________。
LixC+Li1-xCoO2,LixC中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为______________。
-
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
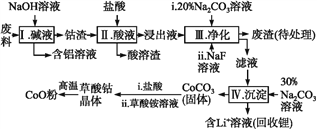
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表。
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是__________。
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过______;废渣中的主要成分除了LiF外,还有______。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是______。
(5)在空气中加热5.49 g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
①加热到210 ℃时,固体质量减轻的原因是__________。
②经测定,加热到210~290 ℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为___________。[已知M(CoC2O4·2H2O)=183 g·mol-1]