-
亚硝酰氯(ClNO)常用于合成洗涤剂、触媒及用作中间体,某学习小组在实验室用Cl2与NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。
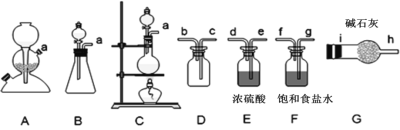
查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氯化物和两种氮的常见氧化物,其中一种呈红棕色。
请回答下列问题:
Ⅰ.Cl2的制备:舍勒发现制备氯气的方法至今还是实验室制取氯气的主要方法之一。
(1)该方法可以选择上图中的______(填字母标号)为Cl2发生装置,该反应的离子方程式为____________。
(2)收集一瓶纯净干燥的氯气。
Ⅱ.亚硝酰氯(ClNO)的制备、实验室可用下图装置制备亚硝酰氯(ClNO):
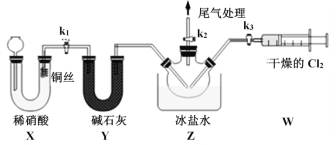
(3)组装好实验装置,检查装置的气密性,然后装入药品。一段时间后,两种气体在Z中反应的现象为________________。
III.亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体)
(4)亚硝酰氯(ClNO)与水反应的离子方程式为__________________________。
(5)滴定终点的现象是________________________________________。
(6)产品中亚硝酰氯(ClNO)的质量分数为____________。
-
亚硝酰氯(ClNO)是一种黄色气体,液体呈红褐色,常用作催化剂和合成洗涤剂,其熔点为-64.5℃,沸点为-5.5℃,遇水反应生成一种氢化物和两种氧化物,与NaOH溶液反应生成两种盐。实验室可由氯气与一氧化氮在常温常压下合成。
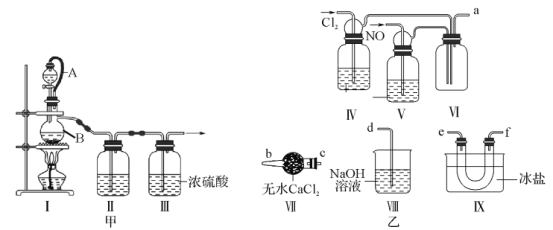
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图甲所示:
①仪器B的名称为____________。
②若该组同学用KClO3和浓盐酸制取Cl2,请写出该反应的离子方程式____________。
(2)乙组同学利用甲组制得的NO和Cl2制备ClNO,装置如图乙所示:
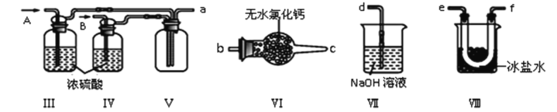
①装置连接顺序为a→_________(按气流自左向右方向,用小写字母表示)。
②装置IV、V除可进一步干燥NO、Cl2外,另一个作用是______________。
③装置IX在实验时可观察到的现象是______________________。
(3)丙组同学测定亚硝酰氯的纯度。他们取Z中所得液体3.0 g溶于水,配制成250 mL溶液,取出25.00 mL,以K2CrO4溶液为指示剂,用0.2000 mol·L-1 AgNO3标准溶液滴定至终点,平均消耗标准溶液的体积为22.50 mL。则亚硝酰氯(ClNO)的质量分数为______________。
-
亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
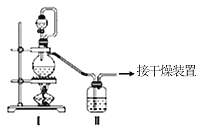
为制备纯净干燥的气体,下表中缺少的药品是:
| 制备原料 | 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净Cl2 | MnO2 | ①________ | 饱和食盐水 |
| 制备纯净NO | Cu | 稀硝酸 | ②________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
①装置连接顺序为a→_______(按气流自左向右方向,用小写字母表示)。
②为了使实验顺利进行,实验中先通入的气体是_____(填Cl2或NO),待装置Ⅴ中充满气体时,再将另一气体缓缓通入,此操作的目的是_____。
③装置Ⅴ生成NOCl的化学方程式是_____。
④装置Ⅵ的作用为_____,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为_______。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。亚硝酰氯(NOCl)的质量分数为_________(用代数式表示即可)。
-
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
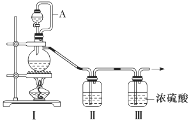
为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净的Cl2 | MnO2 | ①________ | ②________ |
| 制备纯净的NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________。
③装置Ⅶ的作用是________________________________________________________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________。
-
ClNO(名称:亚硝酰氯,熔点﹣64.5℃,沸点:﹣5.5℃)是有机物合成中的重要试剂,为红褐色液体或黄色气体,与水发生反应:2ClNO+H2O=NO+NO2+2HCl,某学习小组在实验室用Cl2和NO按如图装置制备ClNO,并测定其纯度。请回答问题:

(1)仪器a的名称是___;a中反应的离子方程式为___。
(2)试剂X、Y依次为___、____;冰盐水的作用是的作用是___。
(3)实验时,现在三颈烧瓶内通入Cl2,待其中充满黄绿色气体时,再通入NO,这样做的目的是__。
(4)从三颈烧瓶溢出的尾气不能直接通入NaOH溶液中,原因是___。
(5)ClNO与NaOH溶液发生的化学方程式为___。(已知:NO+NO2+2NaOH=2NaNO2+H2O)
-
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:0.5 ℃,有毒)常温下是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成,并以液态储存。
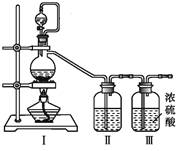
(1)甲组的同学拟制备原料气NO和Cl2,均采用上图制备装置:
①写出NOCl的N元素化合价:_______
②为制备纯净干燥的气体,下表中缺少的药品是(填写在横线上):
| 实验项目 | 装置Ⅰ | 装置Ⅱ |
| 制备的气体 | 烧瓶中 | 分液漏斗中 |
| a .制备纯净干燥的Cl2 | MnO2 | _______ | _______ |
| b .制备纯净干燥的NO | Cu | _______ | _______ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
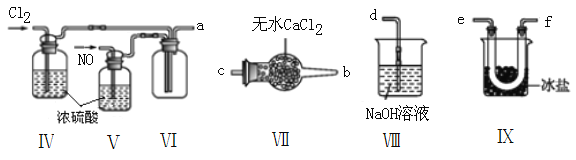
①装置连接顺序为a→____________________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是______________________________。
③装置Ⅵ在实验结束,拆解装置前,应作怎样的处理?_________________________。
④装置Ⅷ中吸收尾气时,NOCl发生的非氧化还原反应的化学方程式为___________________。
-
兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃) 是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂_______。
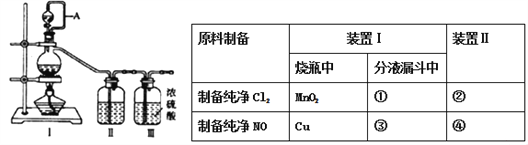
【合成亚硝酰氯】利用制得的NO和Cl2制备NOCl,装置如图所示:
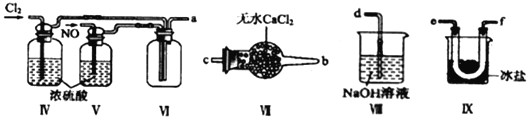
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅶ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________。
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸) 时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。
-
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
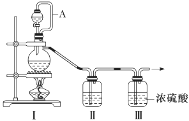
为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净的Cl2 | MnO2 | ①________ | ②________ |
| 制备纯净的NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
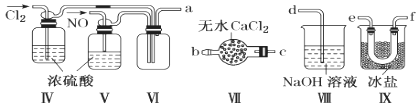
①装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________。
③装置Ⅶ的作用是________________________________________________________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________。
-
亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过如下反应获得:2NO(g)+Cl2(g)  2ClNO(g)。
2ClNO(g)。
(1)氢氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s)  NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)  2ClNO(g) K3
2ClNO(g) K3
则K3=________(用K1和K2表示)。
(2)已知几种化学键的键能数据如下表(亚硝酰氯的结构为Cl—N===O):
| 化学键 | N≡O | Cl—Cl | Cl—N | N===O |
| 键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)  2ClNO(g)反应的ΔH和a的关系为ΔH=_______kJ·mol-1。
2ClNO(g)反应的ΔH和a的关系为ΔH=_______kJ·mol-1。
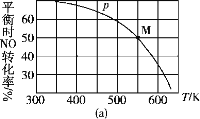
(3)按投料比2∶1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图(a)所示:
①该反应的ΔH________(填“>”“<”或“=”)0。
②在p压强条件下,M点时容器内NO的体积分数为________。
③若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
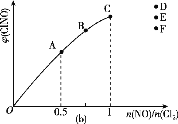
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),在n(NO)/n(Cl2)=1.5时达到平衡状态,ClNO的体积分数可能是图(b)中D、E、F三点中的________点。
-
亚硝酰氯(ClNO)是有机合成中的重要试剂。可通过反应获得:2NO(g)+Cl2(g)  2ClNO(g)
2ClNO(g)
(1)氢氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s)  NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)  2ClNO(g) K3
2ClNO(g) K3
则K3=______________(用K1和K2表示)。
(2)按投料比[n(NO):n(Cl2)=2:1]把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强P(总压)的关系如图A所示:
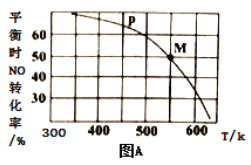
①该反应的△H______0(填“>”“<”或“=”);
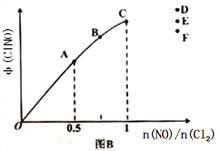
②在P压强条件下,M点时容器内NO的体积分数为_________;
③若反应一直保持在P压强条件下进行,则M点的分压平衡常数Kp=__________(用含P的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数的变化图像如图B,则A、B、C三状态中,NO的转化率最大的是_________点;当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____________点。

















