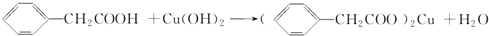-
铁及其化合物在国民经济中占重要地位。FeCO3是白色难溶于水的固体。某研究小组采用如图装置制取FeCO3(夹持装置略)。
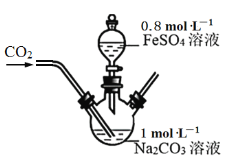
操作的关键是向1mol·L-1Na2CO3溶液(pH=12.1)通入一段时间CO2至溶液pH为7,再滴加一定量0.8mol·L-1FeSO4溶液,产生白色沉淀。
(1)实验室配制FeSO4溶液时,加入少量稀硫酸的原因是________;配制完毕后加入少量还原铁粉的目的是________。
(2)先向1mol·L-1Na2CO3溶液中通入CO2的目的是________;生成FeCO3的离子方程式为________。
(3)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁(摩尔质量为234g·mol-1)补血剂。
①某化学小组同学用KMnO4测定补血剂中亚铁含量,进而计算乳酸亚铁的质量分数。在操作均正确的前提下,发现乳酸亚铁的质量分数总是大于100%,其原因可能是________。
②该小组同学经查阅资料后,改用碘量法测定铁元素的含量计算乳酸亚铁的质量分数。称取2.000g样品,灼烧完全灰化,加足量盐酸溶解,将所有可溶物配成100mL溶液。取25.00mL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.100mol·L-1Na2S2O3溶液滴定(已知:I2+2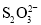 =
=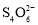 +2I-),滴定时应将Na2S2O3溶液加入________(填“酸式”或“碱式”)滴定管中。当溶液________,即为滴定终点;三次滴定平均消耗20.00mL的Na2S2O3溶液,则乳酸亚铁的质量分数为________%(保留1位小数)。
+2I-),滴定时应将Na2S2O3溶液加入________(填“酸式”或“碱式”)滴定管中。当溶液________,即为滴定终点;三次滴定平均消耗20.00mL的Na2S2O3溶液,则乳酸亚铁的质量分数为________%(保留1位小数)。
-
碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
| 实验 | 试剂 | 现象 |
| 滴管 | 试管 |
| 
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 |
| 0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
□Fe2+ +□____+□ + □H2O=□ Fe(OH)3 +□HCO3−
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
| 操作 | 现象 |
| 实验 IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副产物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是_______________________________________
-
铋酸钠(NaBiO3)是分析化学中的重要试剂,某化学兴趣小组设计下图实验装置制取铋酸钠并进行纯度检测。
(制取)氯气和氢氧化铋反应制取NaBiO3。
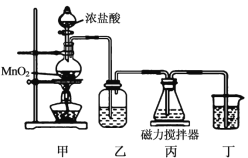
已知:① Bi(OH)3难溶于水,白色。
②装置丙中盛有Bi(OH)3与NaOH溶液混合物。
③NaBiO3不溶于冷水,浅黄色,遇沸水或酸则迅速分解。
(1)装置乙中盛装的试剂是__,装置丁的作用是__。
(2)装置丙中发生反应的离子方程式是_____。
(3)当观察到___现象时,可以初步判断丙中反应已完成。
(4)反应结束后,为了从装置丙中获得更多产品,需要的操作依次:在冰水中冷却结晶、___、干燥。
(5)有人设计如图的装置制取NaBiO3(加热和夹持仪器已略去)。
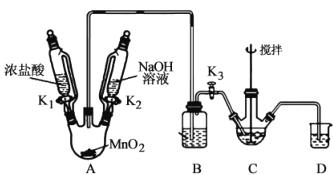
该装置比上一装置具有更高的安全性。
①盛浓盐酸的滴液漏斗中右侧玻璃管的作用是____。
②拆除装置前必须先除去A中残留Cl2以免污染空气。通过控制开关,除去Cl2的操作是___。
(检测纯度)
(6)取上述NaBiO3产品wg,用足量硫酸和MnSO4稀溶液使其还原为Bi3+,再用c mol•L-1的H2C2O4标准溶液滴定生成的MnO (已知:H2C2O4+ MnO
(已知:H2C2O4+ MnO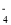 —CO2+Mn2++HO2,未配平),滴定终点时溶液的颜色变化为 __,假设终点时消耗VmL标准溶液。计算该产品的纯度为___(用含w、c、V的代数式表示)。
—CO2+Mn2++HO2,未配平),滴定终点时溶液的颜色变化为 __,假设终点时消耗VmL标准溶液。计算该产品的纯度为___(用含w、c、V的代数式表示)。
-
铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
(1)C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3,反应的化学方程式为__。B装置的作用是__。
(2)当观察到__(填现象)时,可以初步判断C中反应已经完成。
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭__;打开__。
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有_。
Ⅱ.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为__。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmo1•L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为__(用含a、b、c的代数式表示)。
-
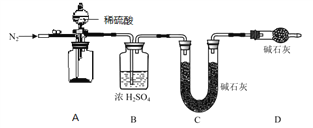
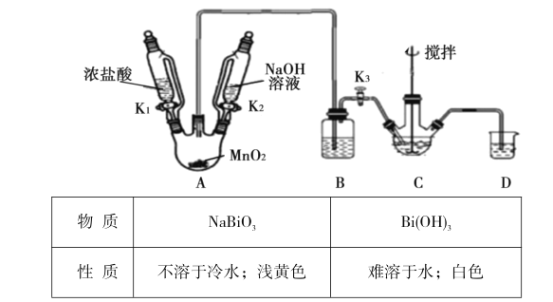
资料显示:“氨气可在纯氧中安静燃烧生成稳定的单质和化合物……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式
是__ _ __; 碱石灰的作用是____ ___。
(2)将产生的氨气与过量的氧气通到装置
B(催化剂为铂石棉)中,用酒精喷灯加热。
请写出氨催化氧化的化学方程式是 ________ ;
试管内气体变为红棕色。
(3)将过量的氧气与A产生的氨气分别从a、b
两管进气口通入到装置C中,并在b管上端点燃氨气:①两气体通入的先后顺序是______ ___;
②氨气燃烧的化学方程式是___ 。
-
氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物) 做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是_______。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N 原子的杂化形式为____。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____。原因是____。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______。
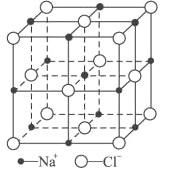
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
 。
。
-
碘化亚铜(CuI)是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而制得。选取铜片、石墨、KI溶液组成电化学装置制取CuI。为确认反应情况,通电前在溶液中又加入了少量酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法不正确的是
A.铜片做阳极,石墨做阴极
B.白色沉淀在靠近阳极处产生
C.阴极区溶液变红的原因:2H++2e-=H2↑,促进H2O电离,c(OH-)升高
D.阳极区溶液变蓝的原因:4OH--4e-=2H2O+O2↑,O2将I-氧化为I2,I2遇淀粉变蓝
-
硫代硫酸钠(Na2S2O3·5H2O),俗称大苏打,是无色透明晶体,易溶于水,易被氧化。是一种重要的化工产品,临床上用于氰化物的解毒剂,工业上也用于纸浆漂白的脱氯剂。某兴趣小组在实验室用如下装置(夹持仪器略去)模拟硫代硫酸钠生产过程。
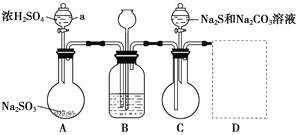
(1)仪器a的名称为_________。
(2)装置A中发生反应的化学方程式为_____________________________。
(3)为提高产品纯度,应使烧瓶C中Na2S和Na2CO3恰好完全反应,则烧瓶C中Na2S和Na2CO3物质的量之比为____________。
(4)装置B中盛有饱和NaHSO3溶液,装置B的作用是_________、__________。
(5)装置D用于处理尾气,可选用的最合理装置(夹持仪器已略去)为____(填序号)。
(6)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
已知:Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。
限选试剂:稀HNO3、稀H2SO4、稀HCl、蒸馏水
-
(12分) 某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
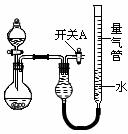
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | | H2O |
| ② | NaOH固体、浓氨水 | NH3 | |
| ③ | Na2CO3固体、稀H2SO4 | CO2 | |
| ④ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
请回答下列问题:
(1)简述如何检查该装置的气密性: 。
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度。你认为是否可行?请简述原因 。
(3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有
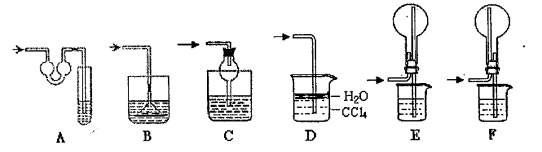
(4)实验③中,量气管中的液体最好是 。
A.H2O B.CCl4
C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,② ,③视线与凹液面最低处相平。
(6)实验④获得以下数据(所有气体体积均已换算成标准状况)
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
根据上述合理数据计算镁铝合金中铝的质量分数 。
-
苯乙酸铜是合成优良催化剂、传感材料﹣﹣纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
 ;
;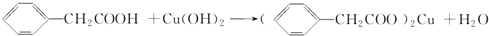
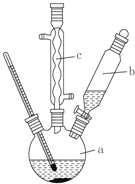
制备苯乙酸的装置示意图如图(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。回答下列问题:
(1)在250mL三口瓶a中加入70mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是______。
(2)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温到130℃继续反应。在装置中,仪器b的作用是滴加苯乙腈;仪器c的作用是__________。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_________。下列仪器中可用于分离苯乙酸粗品的是_________(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是_________,最终得到44g纯品,则苯乙酸的产率是__________。(小数点后保留一位)(相对分子质量:苯乙腈117;苯乙酸136)
(4)用CuCl2•2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是___________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________。

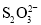 =
=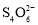 +2I-),滴定时应将Na2S2O3溶液加入________(填“酸式”或“碱式”)滴定管中。当溶液________,即为滴定终点;三次滴定平均消耗20.00mL的Na2S2O3溶液,则乳酸亚铁的质量分数为________%(保留1位小数)。
+2I-),滴定时应将Na2S2O3溶液加入________(填“酸式”或“碱式”)滴定管中。当溶液________,即为滴定终点;三次滴定平均消耗20.00mL的Na2S2O3溶液,则乳酸亚铁的质量分数为________%(保留1位小数)。


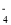 (已知:H2C2O4+ MnO
(已知:H2C2O4+ MnO

 。
。



 ;
;