-
盐溶液受盐的水解影响,导致性质具有一定的复杂性。
Ⅰ.在0.1mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O 2HCrO4-
2HCrO4- 2CrO42-+2H+
2CrO42-+2H+
(1) K2Cr2O7溶液呈___性。在强碱溶液中,铬元素的主要存在形式为______ (填离子符号)。向K2Cr2O7溶液中加入适量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)将______(填“增大”、“减小”或“不变”)。
(2)向K2Cr2O7溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液pH减小,则生成的砖红色沉淀的化学式为___________。
Ⅱ.已知25 ℃时,0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,晶体溶解后,溶液的pH增大。对上述现象有两种不同的解释:
甲同学:醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;
乙同学:醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。(已知25 ℃时CH3COONH4溶液呈中性)
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
若____(填“甲”或“乙”)的解释正确,溶液的pH应_____(填“增大”“减小”或“不变”)。
(2)常温下,将0.1 mol·L-1的醋酸和0.1 mol·L-1的NaOH溶液等体积混合,所得混合溶液的pH=8。写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(CH3COO-)=____ mol·L-1。
-
已知K2Cr2O7溶液中存在平衡: +H2O
+H2O 2
2 +2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
| 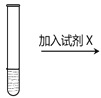
5mL0.1mol/LK2Cr2O7溶液 | 序号 | 试剂X |
| ⅰ | 1mL1mol·L-1 K2Cr2O7 溶液 |
| ⅱ | 1mL1 mol·L-1 K2CrO4溶液 |
| ⅲ | 5~15滴浓硫酸 |
| ⅳ | 5~15滴浓盐酸 |
| ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是_____(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
| 序号 | 试剂X | 预期现象 | 实际现象 |
| ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
| ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | 溶液橙色加深 | 溶液颜色变浅 |
| ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
| ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
| ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是_____,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为_____。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了下实验,验证了该反应的发生。
方案:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式______。
-
Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O 2HCrO4
2HCrO4 2CrO42-+2H+
2CrO42-+2H+
(1)重铬酸钾溶液呈______性,在强碱溶液中,铬元素的主要存在形式为________(填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)将______(填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一种溶质,则该溶质是 ________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1。排放前拟用沉淀法除去这两种
离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入________________(填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______。
-
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色)
2H++ 2CrO42-(黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+ = 2Cr3+(绿色) + 6Fe3+ + 7H2O。
下列分析正确的是
A. 实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B. 实验②能说明氧化性:Cr2O72-> Fe3+
C. CrO42-和Fe2+在酸性溶液中可以大量共存
D. 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
-
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2 O7 2-(橙色)+H2O ⇌ 2H++2CrO4 2-(黄色)
①向 2 mL 0.1 mol·L-1 K2Cr2O7 溶液中滴入 3 滴 6 mol·L-1 NaOH 溶液,溶液由橙色变为黄色;向所得溶液中再滴入 5 滴浓 H2SO4,溶液由黄色变为橙色。
②向 2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2 溶液,溶液由橙色变为绿色, 发生反应:Cr2 O7 2-+14 H++ 6Fe2+=2Cr3+(绿色) +6Fe3++7H2 O。
下列分析正确的是
A. 实验②能说明氧化性:K2Cr2O7>Fe3+
B. 实验①和②均能证明K2Cr2O7溶液中存在上述平衡
C. CrO4 2-和 Fe2+在酸性溶液中可以大量共存
D. 稀释 K2Cr2O7溶液时,溶液中各离子浓度均减小
-
已知重铬酸根(Cr2O72-)和铬酸根(CrO42-)离子间存在如下平衡:Cr2O72- +H2O  2CrO42-+2H+。在装有4mL0.1mol·L-1K2Cr2O7溶液中加入1mol·L-1的NaOH数滴,溶液的颜色由_________色变____________色,平衡常数的表达式是 K= __________________________。
2CrO42-+2H+。在装有4mL0.1mol·L-1K2Cr2O7溶液中加入1mol·L-1的NaOH数滴,溶液的颜色由_________色变____________色,平衡常数的表达式是 K= __________________________。
-
现有常温下的0.1 mol/l纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加 (填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。答: 。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是 。
A.c(Na+)>2c(CO32—)
B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)
D.c(CO32—)+c(HCO3—)=0.1 mol·L-1
E.c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+c(CO32—)
(4)室温下pH均为a的Na2CO3和NaOH溶液中,水电离产生的c(OH—)之比= 。
-
(12分)现有常温下的0.1 mol·l-1纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加 (填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知常温下0.1 mol·L-1Na2CO3中,发生水解的CO32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。
答: 。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是 。(双选,填序号)
A.c(Na+)>2c(CO32—)
B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)
D.c(CO32—)+c(HCO3—)=0.1 mol·L-1
E.c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+c(CO32—)
(4)室温下,pH均为13的Na2CO3和NaOH溶液中,水电离产生的c(OH—)之比= 。
(5)25℃下,CuSO4溶液中的c(Cu2+)为0.020 mol/l,如果要生成沉淀,应调整溶液的pH大于 。
(25℃下,Cu(OH)2 的 Ksp=2.0×10-20)
-
已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72- (橙色)+H2O 2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
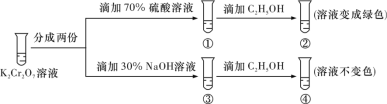
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH氧化
C.对比②和④可知K2Cr2O7碱性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
-
Ⅰ.K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l) 2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__;往上述溶液中加入氢氧化钠溶液现象为___;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着__这种改变的方向移动。
2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__;往上述溶液中加入氢氧化钠溶液现象为___;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着__这种改变的方向移动。
Ⅱ. 为了证明化学反应有一定的限度,利用铁离子可以氧化碘离子的反应进行了如下探究活动:
(1)步骤1:取8mL0.1mol•L﹣1的KI溶液于试管,滴加0.1mol•L﹣1的FeCl3溶液5~6滴,振荡;
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加5~6滴0.1mol•L﹣1___(试剂名称),振荡,未见溶液呈血红色。
(2)探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想:
猜想一:________________
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色
为了验证猜想,在查阅资料后,获得下列信息:
信息一:Fe3+可与[Fe(CN)6]4﹣反应生成蓝色沉淀,反应的离子方程式为___,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
信息二:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
结合新信息,请你完成以下实验:各取少许步骤3的水溶液分别于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
| 实验操作 | 预期现象 | 结论 |
| 实验1:①___________ | ②______ | 则“猜想一”不成立 |
| 实验2:在试管B加入少量乙醚,充分振荡,静置 | ③______ | 则“猜想二”成立 |
 2HCrO4-
2HCrO4- 2CrO42-+2H+
2CrO42-+2H+
