-
(15分)I.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 , 10C+P4O10==P4+10CO
每生成 1molP4 时,就有________mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2 用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入amolL-1I2溶液V1ml,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗bmolL-1 Na2S2O3溶液V2ml.该溶液中维生素C的物质量是________mol。
(4)在酸性溶液中,碘酸钠(KIO3)和亚硫酸钠可发生如下反映:
2IO3-+5SO32-+2H+==I2+5SO42++H2O
生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL
0.01mol·L-1Na2SO3溶液的体积/mL
H2O的体积/mL
实验温度/℃
溶液出现蓝色时所需时间/s
实验1
5
V1
35
25
实验2
5
5
40
25
实验3
5
5
V2
0
该实验的目的是______;表中V2=_________mL.
II稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH ≈3. Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
□Ce3++□H2O2+□H2O=====□Ce(OH)4↓+□________
高一化学实验题简单题查看答案及解析
-
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由石英砂和焦炭在高温下制备粗硅的化学反应方程式:_____________。
②整个制备过程必须严格控制无水无氧。SiHCl3 遇水剧烈反应生成H2SiO3、HCl 和另一种气体,写出配平的化学反应方程式: _____________;H2 还原SiHCl3 过程中若混入O2,可能引起的后果是______________。
(2)下列有关硅材料的说法正确的是_____________ (填字母代号)。
A.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
B.石英坩埚耐高温性强,可用于加热熔融氢氧化钠
C.神舟10 号飞船所用太阳能电池板可将光能转换为电能,所用转换材料单晶硅也可以制作电脑芯片
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故可采用盐酸为抛光液抛光单晶硅
F.玛瑙饰品的主要成分与建筑材料砂子相同
高一化学填空题中等难度题查看答案及解析
-
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由石英砂和焦炭在高温下制备粗硅的化学反应方程式:_____________。
②整个制备过程必须严格控制无水无氧。SiHCl3 遇水剧烈反应生成H2SiO3、HCl 和另一种气体,写出配平的化学反应方程式: _____________;H2 还原SiHCl3 过程中若混入O2,可能引起的后果是______________。
(2)下列有关硅材料的说法正确的是_____________ (填字母代号)。
A.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
B.石英坩埚耐高温性强,可用于加热熔融氢氧化钠
C.神舟10 号飞船所用太阳能电池板可将光能转换为电能,所用转换材料单晶硅也可以制作电脑芯片
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故可采用盐酸为抛光液抛光单晶硅
F.玛瑙饰品的主要成分与建筑材料砂子相同
高一化学填空题中等难度题查看答案及解析
-
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) ΔH1=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是________。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
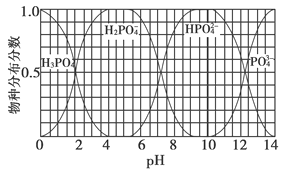
①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示)。
(4)磷的化合物三氯氧磷(
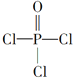 )与季戊四醇(
)与季戊四醇(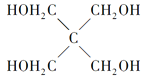 )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
)以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示: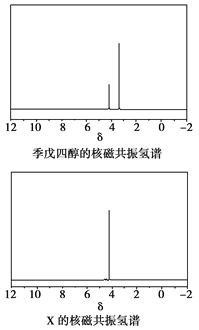
①酸性气体是______________________(填化学式)。
②X的结构简式为__________________。
高一化学填空题困难题查看答案及解析
-
(8分)磷单质及其化合物的有广泛应用。
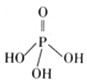
(1)三聚磷酸可视为三个磷酸分子(磷酸结构式见图)之间脱去两个分子产物,其结构式为________。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为________
(2)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为________。
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)
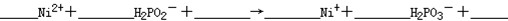
(b)6H2PO2- +2H+ = 2P+4H2PO3-+3H2↑
高一化学填空题简单题查看答案及解析
-
W是由A、B两种元素组成的AB2型化合物。
(1) 若W是最常见的温室气体则其结构式为 ;
(2)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛。该反应的化学方程式为 。
(3)若W是离子化合物,其阴、阳离子均含18个电子,
①当阴、阳离子个数比为2∶1时W的电子式为 ;
②当阴、阳离子个数比为1∶1时阴离子的电子式为 。
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸。①如A、B为相邻周期时B在元素周期表中的位置为 。W的水溶液被双氧水氧化的化学方程式为 。
②如果A元素的周期序数是B元素的两倍,A的最高价氧化物对应水化物的分子式为 。
高一化学填空题困难题查看答案及解析
-
硅及其化合物在材料领域中应用广泛。下列说法正确的是
A.水晶项链是硅酸盐制品 B.硅单质广泛用于光纤通讯
C.利用盐酸刻蚀石英制作艺术品 D.硅酸钠可用于制备木材防火剂
高一化学选择题简单题查看答案及解析
-
硅及其化合物在材料领域中应用广泛.下列说法正确的是
A. 硅酸钠可用于制备木材防火剂
B. 硅单质广泛用于光纤通讯
C. 利用盐酸刻蚀石英制作艺术品
D. 水晶项链是硅酸盐制品
高一化学单选题简单题查看答案及解析
-
硅及其化合物在材料领域中应用广泛。下列说法正确的是
A.水晶项链是硅酸盐制品 B.硅单质广泛用于光纤通讯
C.利用盐酸刻蚀石英制作艺术品 D.硅酸钠可用于制备木材防火剂
高一化学选择题中等难度题查看答案及解析
-
硅及其化合物在材料领域中应用广泛。下列说法正确的是( )
A.水晶项链是硅酸盐制品
B.硅单质广泛用于光纤通讯
C.利用盐酸刻蚀
石英制作艺术品
D.硅酸钠可用于制备木材防火剂
高一化学选择题简单题查看答案及解析