-
氯元素是生产生活中常见的非金属元素。某同学探究Cl2及其化合物的性质。
(1)把Cl2通入水中,反应的化学方程式是 。
(2)用氯水进行如下表实验:
实验
操作
现象
Ⅰ
把氯水点在蓝色石蕊试纸上
试纸先变红后褪色
Ⅱ
向氯水中滴加足量AgNO3溶液,不断振荡
ⅰ.有白色沉淀生成
ⅱ.稍后,溶液变为无色
① 实验Ⅰ的现象说明,氯水具有的性质是 。
② 实验Ⅱ:a.ⅰ现象的白色沉淀是 。
b.综合ⅰ、ⅱ现象,该同学推测实验Ⅱ发生的反应为:
Cl2 + AgNO3 + =HNO3 +AgCl↓+ (将反应补充完整)
③ 为探究实验Ⅰ中试纸褪色的原因及Ⅱ中另一种反应产物,该同学设计实验如下:
c.将少量稀硝酸点在蓝色石蕊试纸上,试纸变红未褪色;
d.……
上述实验d的方案是 。
(3)该同学查阅资料得知,最初,人们直接用氯气作漂白剂,但使用起来不方便,效果也不理想。经过多年的实验、改进,才有了今天常用的漂白粉。
① 你认为“使用起来不方便,效果也不理想”的原因是 。
② 科研人员以氯气、石灰石、水为原料制取漂白粉,有关反应的化学方程式是: 。
高一化学实验题困难题查看答案及解析
-
学习了元素周期律的知识后,同学们设计了多个实验探究元素性质的递变规律。
Ⅰ.甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,选取C、Si、S三种非金属元素的常见化合物,设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究。
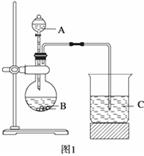
(1)甲组同学设计实验时,A中装H2SO4,则B,C中分别装
B____________________C__________________;
(2)烧杯C中发生反应的离子方程式 ____________________,
(3)通过实验得出的结论:元素非金属性强弱顺序为 ________________。(填元素符号)
Ⅱ.乙组同学认为利用图1装置可直接比较Cl2和S单质的氧化性强弱,他们选择的药品是浓盐酸,KMnO4固体, Na2S溶液。
(4)预计C中观察到的现象是__________________________________________________,
(5)C中反应的离子方程式为_____________________________________________________。
(6)有同学提出该装置存在明显缺陷需加以改进,你认为缺陷是_____________________。
高一化学实验题中等难度题查看答案及解析
-
下列有关说法体现了化学与生产、生活、社会的密切关系。其中不正确的是( )
A.利用焰色反应在绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物。
B.不锈钢和普通钢的主要成分是铁,所以化学性质完全相同
C.铝合金的硬度和强度均高于纯铝
D.氮化硅陶瓷、氧化铝陶瓷、光导纤维等属于新型无机非金属材料。
高一化学选择题简单题查看答案及解析
-
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究 Cl2 的漂白性。
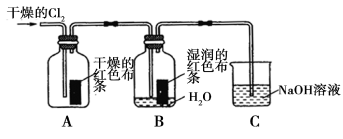
① 通 入Cl2 后 , 观 察 到 的 现 象 是 根 据 现 象 可 得 出 的 结 论是 。
②集气瓶 B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究 Cl2 的氧化性。
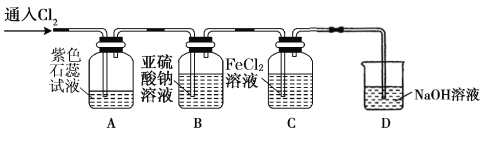
①实验开始后,观察装置 A 中的现象是 。
②装置 C 中发生反应的离子方程式是 。
③停止通入氯气,取装置 B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入 Cl2 时装置 B 中发生 反应的离子方程式是 。
高一化学实验题极难题查看答案及解析
-
(16分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
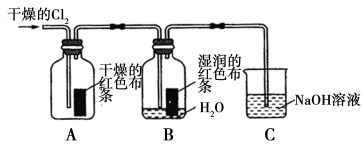
①通入Cl2后,观察到的现象是 根据现象可得出的结论是______。
②集气瓶B发生反应的离子方程式是______。
③C装置的作用是______,若有2.24 L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子数为________mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
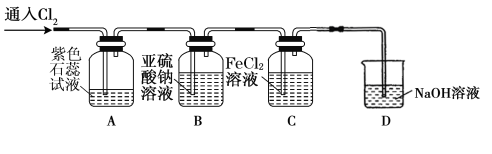
①实验开始后,观察装置A中的现象是: 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生反应的离子方程式是 。
高一化学填空题困难题查看答案及解析
-
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
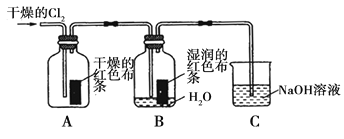
①通入Cl2 后,观察到的现象是 根据现象可得出的结论是 。
②集气瓶B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
①实验开始后,观察装置A 中的现象是 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生 反应的离子方程式是 。
高一化学填空题困难题查看答案及解析
-
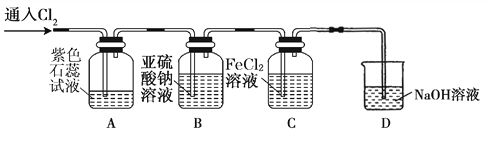
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
①通入Cl2 后,观察到的现象是 根据现象可得出的结论是 。
②集气瓶B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
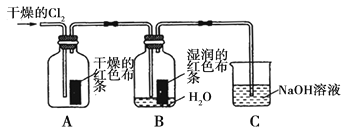
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
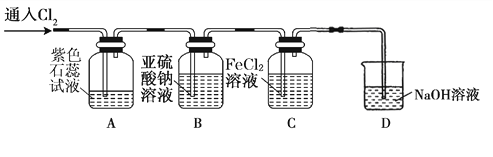
①实验开始后,观察装置A 中的现象是 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生 反应的离子方程式是 。
高一化学填空题困难题查看答案及解析
-
氯元素是中学化学中常见的重要非金属元素之一,氯元素的单质及其化合物在生产与生活中有着重要的用途,依据所学知识完成下列问题:
Ⅰ.实验室制备氯气的化学方程式是_____________________;多余的氯气用氢氧化钠溶液吸收,其离子方程式为_________________
Ⅱ.常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国世界卫生组织(WHO)列为高效安全消毒剂。常温下,它可用氯酸钠固体与浓盐酸反应制备得到,还有 NaCl与C12生成。
(1)写出并配平该反应的化学方程式____________________。
(2)如果反应中生成标准状况下11.2L 氯气,则被氧化的 HCl的物质的量为_______,转移电子数为_________。
(3)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的臭味。取适量ClO2,通入到含有H2S(二元弱酸)的水中,再向共中加入少量氯化钡溶液,发现有白色沉淀生成。写出ClO2与H2S水溶液反应的离子方程式____________。
高一化学解答题简单题查看答案及解析
-
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。为探究氯气的性质,某同学设计了如图1所示的实验装置。
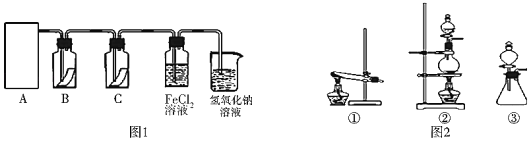
(1)实验中制取氯气的反应原理为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,该反应中还原剂是_____,还原产物是_____
(2)利用(1)中制气原理,从图2中选择合适的制气装置(A处):_____(填写序号)。
(3)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,理论上装置_____中的红色布条退色,但实验过程中该同学发现装置B、C中的布条均退色,其原因可能是_____,说明该装置存在明显的缺陷,请提出合理的改进方法_____
(4)为了验证氯气的氧化性,将氯气通入FeCl2溶液中,写出氯气与FeCl2溶液反应的离子方程式_____
(5)工业上常用石灰乳吸收制氯气的尾气制得漂白粉,漂白粉的有效成分是_____(填化学式)。
高一化学实验题中等难度题查看答案及解析
-
现有如下说法:(1)在水中氢、氧原子之间均以化学键相结合;(2)金属元素和非金属元素化合形成离子键;(3)根据电离方程式:HCl=H++Cl—,推断HCl中存在离子键;(4)H2分子和Cl2分子的反应过程是:H2、Cl2分子里的共价键发生断裂,生成H、Cl原子,然后H、Cl原子形成离子键的过程。上述说法正确的是
A、只有(1)、(2)正确 B、只有(3)、(4)正确
C、全部正确 D、全部不正确
高一化学选择题简单题查看答案及解析