-
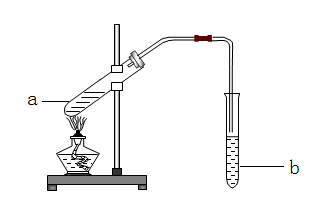
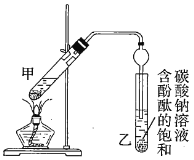
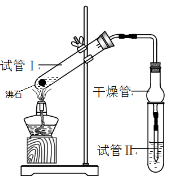
下图为实验室制备乙酸乙酯的装置。

 已知下列数据:
已知下列数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙醇 | -114 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | | 338 | 1.84 |
 (1)写出试管a中主要发生反应的化学方程式 。
(1)写出试管a中主要发生反应的化学方程式 。
(2)导管要插在试管b中饱和Na2CO3溶液的液面以上,原因是: 。
 (3)试管b中饱和Na2CO3的作用: 。
(3)试管b中饱和Na2CO3的作用: 。
 (4)开始用小火加热试管a中的混合液,其原因是__ 。
(4)开始用小火加热试管a中的混合液,其原因是__ 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有 (填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
 (6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
(6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
-
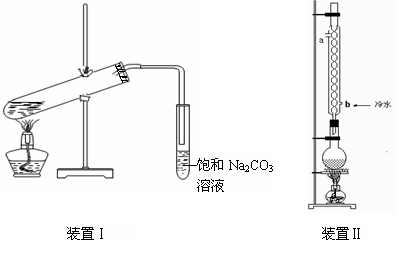
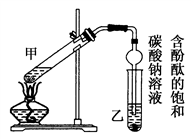
(9分)下图装置Ⅰ是实验室制乙酸乙酯的常用装置:
实验中所用的某些试剂及产物的相关数据如下:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 98%H2SO4 | 10 | 338 | 1.84 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式,浓H2SO4的作用是。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入________(填仪器名称),用力振荡,静置,________(填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因:。
-
(9分)下图装置Ⅰ是实验室制乙酸乙酯的常用装置:
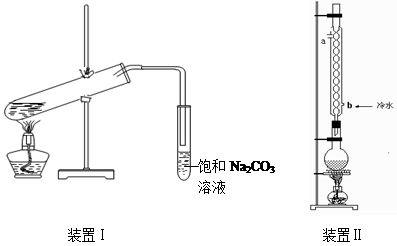
(装置1大试管口是否要加橡胶塞)
实验中所用的某些试剂及产物的相关数据如下:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 98%H2SO4 | 10 | 338 | 1.84 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式(在反应物和生成物中标出18O的位置),浓H2SO4的作用是________。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入________(填仪器名称),用力振荡,静置,________(填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因:。
-
(9分)下图装置Ⅰ是实验室制乙酸乙酯的常用装置:
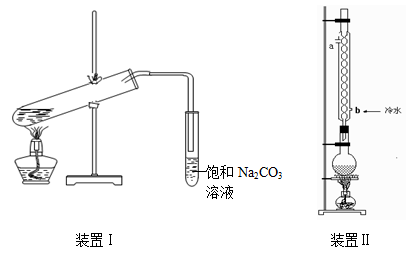
(装置1大试管口是否要加橡胶塞)
实验中所用的某些试剂及产物的相关数据如下:
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 98%H2SO4 | 10 | 338 | 1.84 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式(在反应物和生成物中标出18O的位置)________,浓H2SO4的作用是________。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入________(填仪器名称),用力振荡,静置,________(填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因:________。
-
已知下列数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/ |
| 乙醇 | 
| 78.3 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | 
| 77 | 0.90 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制 浓硫酸、
浓硫酸、 乙醇(含
乙醇(含 )和
)和 乙酸的混合溶液。
乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热 。
。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)配制①中混合溶液的方法为_______________________________;反应中浓硫酸的作用是____________________________;写出制取乙酸乙酯的反应的化学方程式:____________________________(标出 )。
)。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要原因是____________________________;步骤③所观察到的现象是_______________________________________;欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有___________;分离时,乙酸乙酯应从仪器_____________(填“下口放”或“上口倒”)出。
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如下表:
| 实验 | 乙醇/ | 乙酸/ | 乙酸乙酯/ |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
表中数据x的范围是__________________;实验①②⑤探究的是_____________________。
-
已知下列数据:
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。
②按上图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3 min~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)反应中浓硫酸的作用是______________________________________;
写出制取乙酸乙酯的化学方程式:_____________________________。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是___________________;
步骤③所观察到的现象是_____________________________________;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________;分离时,乙酸乙酯应从仪器________(填“下口放”或“上口倒”)出。
-
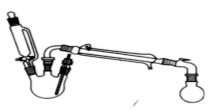
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | −84 | 76.5 | 不溶 |
合成反应:在三颈烧瓶中加入乙醇5mL,硫酸5mL,2小片碎瓷片。漏斗加入乙酸14.3 mL,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。分离提纯:将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)制取乙酸乙酯化学方程式为:_____________ _______。
(2)浓硫酸与乙醇如何混合? 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_______(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(5)蒸出的粗乙酸乙酯中主要有哪些杂质? 。
(6)饱和的Na2CO3溶液洗涤除去乙酸,能否换成NaOH溶液?若不能,为什么?(用化学方程式表示) ; 。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
-
(12分)下图装置Ⅰ是实验室制乙酸乙酯的常用装置:
实验中所用的某些试剂及产物的相关数据如下:
| 物 质 |  熔点/℃ 熔点/℃
| 沸点/℃ |
| 乙 醇 | -114 | 78 |
| 乙 酸 | 16.6 | 117.9 |
| 乙酸乙酯 | -83.6 | 77.5 |
| 98%H2SO4 | 10 | 338 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式 ,浓H2SO4的作用是 。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振荡,静置, (填现象),然后将产物从__ __口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因: 。
-
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。某学生在实验室利用下图的实验装置制备乙酸乙酯并研究其反应条件。
| 物质 | 沸点/C | 密度/gcm3 |
| 乙醇 | 78.0 | 0.79 |
| 乙酸 | 117.9 | 1.05 |
| 乙酸乙酯 | 77.5 | 0.90 |
| 异戊醇 | 131 | 0.8123 |
| 乙酸异戊酯 | 142 | 0.8670 |
实验步骤如下:
① 配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
② 按图连接实验装置并检验气密性
③ 分别在试管1、试管2中加入反应液
④ 用酒精灯微热3min,再加热使之微微沸腾3min
⑤ 分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:______________(按着加入的先后顺序写出名称),乙醇过量的目的是:_______________;
(2)该反应的平衡常数表达式K=______________;
(3)试管Ⅱ中所盛试剂为___________,欲将其物质分离使用的仪器为___________,在充分振荡的过程中,发生的反应为________________;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_________mL和_________mol/L;
②分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是____________;
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是_______________;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中_______的得到,那么产率会_____(“较高”或“偏低”);
-
已知下列数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 乙醇 | -144 | 78.0 | 0.789 |
| 乙酸 | 16.6 | 118 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓硫酸(98%) | - | 338 | 1.84 |
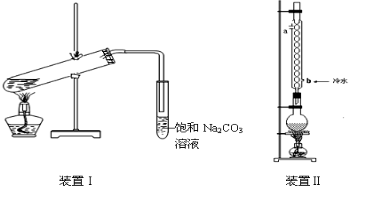
下图为实验室制取乙酸乙酯的装置图。

(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄 B.下层液体红色变浅或变为无色 C.有气体产生 D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:

①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外 、锥形瓶 ,还需要的玻璃仪器有__________、________、________,收集乙酸的适宜温度是________。


已知下列数据:
(1)写出试管a中主要发生反应的化学方程式 。
(3)试管b中饱和Na2CO3的作用: 。
(4)开始用小火加热试管a中的混合液,其原因是__ 。
(6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。









