-
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | −84 | 76.5 | 不溶 |
合成反应:在三颈烧瓶中加入乙醇5mL,硫酸5mL,2小片碎瓷片。漏斗加入乙酸14.3 mL,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。分离提纯:将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)制取乙酸乙酯化学方程式为:_____________ _______。
(2)浓硫酸与乙醇如何混合? 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_______(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(5)蒸出的粗乙酸乙酯中主要有哪些杂质? 。
(6)饱和的Na2CO3溶液洗涤除去乙酸,能否换成NaOH溶液?若不能,为什么?(用化学方程式表示) ; 。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
-
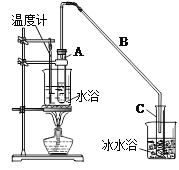
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: ;
;
反应物和生成物的物理性质如下表:
| | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
制备粗品:将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入
饱和食盐水,振荡、静置、分层,环己烯在 层(填上
或下),分液后用 (填序号)洗涤:
a.KMnO4溶液 b.稀H2SO4c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从 (填字母)口进入;蒸馏时要加入生石灰的目的 。

③上图蒸馏装置收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 :a.蒸馏时从70℃开始收集产品;b.环己醇实际用量多了;c.制备粗品时环己醇随产品一起蒸出;d.是可逆反应,反应物不能全部转化
(3)区分环己烯精品和粗品(是否含有反应物)的方法是 。
-
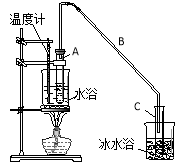
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: ;
;
反应物和生成物的物理性质如下表:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
制备粗品:将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入
饱和食盐水,振荡、静置、分层,环己烯在 层(填上
或下),分液后用 (填序号)洗涤:
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从 (填字母)口进入;蒸馏时要加入生石灰的目的 。
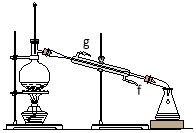
③上图蒸馏装置收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 :a.蒸馏时从70℃开始收集产品;b.环己醇实际用量多了;c.制备粗品时环己醇随产品一起蒸出;d.是可逆反应,反应物不能全部转化
(3)区分环己烯精品和粗品(是否含有反应物)的方法是 。
-
苯甲酸甲酯是重要的化工原料,某化学兴趣小组仿照实验室制乙酸乙酯的原理以苯甲酸(C6H5COOH)和甲醇为原料制备苯甲酸甲酯。有关数据如下:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度(g/cm3) | 水溶性 |
| 苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
| 甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
| 苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。
回答下列问题:
(1)该反应的化学方程式为__________,该反应的原子利用率是_______。
己知:原子利用率=(预期产物的总质量/全部反应物的总质量)×100%
(2)实验中,应选择(如下图)_____(填序号)作为冷凝回流装置,该仪器的名称为______。
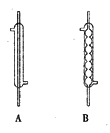
(3)使用过量甲醇的原因是__________。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制。
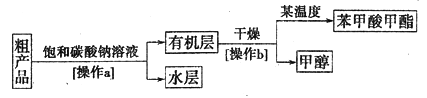
(4)饱和碳酸钠溶液的作用是________,操作a的名称为________。
(5)由于有机层和水层的密度比较接近,兴趣小组的同学无法直接判断有机层在上层还是下层,请你设计简单易行的方案,简述实验方法,可能的现象及结论__________。
(6)该实验中制得苯甲酸甲酯8.30g,则苯甲酸甲酯的产率为________。
-
常温常压下,下列各组物质的物理性质排列不正确的是( )
A.密度:四氯化碳>乙酸乙酯>水 B.沸点:乙醇>丙烷>乙烷
C.在水中的溶解度:丙三醇>苯酚>1-氯丁烷 D.熔点:对二甲苯>邻二甲苯>间二甲苯
-
将甲、乙两种有机物在常温常压下的混合物分离。已知它们的物理性质如下:
| 物质 | 密度/(g/cm3) | 沸点/℃ | 水溶性 | 溶解性 |
| 甲 | 0.7893 | 68.5 | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
则应采用的分离方法是( )
A. 分液 B. 蒸馏 C. 过滤 D. 萃取
-
将甲、乙两种有机物在常温常压下的混合物分离。已知它们的物理性质如下:
| 物质 | 密度/(g/cm3) | 沸点/℃ | 水溶性 | 溶解性 |
| 甲 | 0.7893 | 68.5 | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
则应采用的分离方法是( )
A.分液 B.蒸馏 C.过滤 D.萃取
-
实验室中制备对氯苯甲酸的反应以及装置如图所示:

常温下,物质的有关数据和性质如表所示:
| 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 颜色 | 水溶性 |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 |
实验步骤:在规格为250mL的仪器A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩,冷却,然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量。
请回答下列问题:
(1)仪器A的名称为______________________。
(2)仪器B是冷凝管,其起到的主要作用是:________________,实验过程中,冷却水从________口。
(3)实验过程中两次过滤、洗涤操作,第一次过滤的滤渣成分为___________(填化学式),洗涤该滤渣用热水,目的是_________________________________,第二次过滤后,洗涤滤渣用冷水,目的是______________________。
(4)过滤、洗涤操作中能用到的仪器是___________(填选项字母)。
a.烧杯 b.分液漏斗 c.锥形瓶 d.玻璃棒
(5)第一次过滤后的滤液中加入硫酸,出现的现象是___________。
(6)如图是温度对对氯苯甲酸产率的影响关系,最后干燥、称量得到的对氯苯甲酸的质量为___________(保留小数点后两位)。
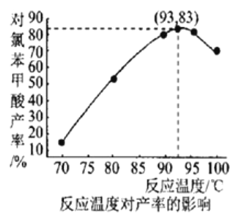
-
某化学小组依据实验室制备乙烯的原理,利用如图装置,用环己醇制备环己烯。

已知:① +H2O
+H2O
②相关有机物的物理性质如下:
| 密度(g/cm3) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
实验过程:
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__。
②试管C置于冰水浴中的目的是__。
③环己烯粗品中含有的杂质主要是__、少量H2O和少量酸性物质等。
(2)制备精品:
①环己烯粗品中加入饱和食盐水,振荡、静置后,环己烯在__(填“上层”、“下层”或“不分层”),分离后再用__(填序号)洗涤可得较纯净的环己烯样品。
a.KMnO4溶液 b.稀H2SO4 c.饱和Na2CO3溶液
②将较纯净环己烯样品按如图装置蒸馏,冷却水应从__口(填“d”或“e”)进入。

③收集产品时,控制的温度应在__左右,实验制得的环己烯精品质量低于理论产量,试分析可能的原因是__。
a.蒸馏时从70℃开始收集产品
b.环己醇的实际用量多了
c.制备粗品时环己醇随产品一起蒸出
-
(I) 和
和 的一些物理性质如下表:
的一些物理性质如下表:
| 物质 | 熔点 | 沸点 | 密度 | 水溶性 |
| 
| -10℃ | 212℃ | 1.1622g/mL | 不溶于水 |
| 
| 54℃ | 238℃ | 1.1581g/mL | 不溶于水 |
①分离这两种物质混合物可采用的方法是__。(填序号)
A.过滤 B.分液 C.蒸发 D.分馏
②实验需要用到的主要玻璃仪器是___。
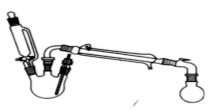
(II)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有___、___等。
(2)若用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为___、___。
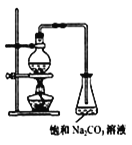
(3)此反应以浓硫酸为催化剂,可能会造成___、__问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
| 同一反应时间 | 同一反应温度 |
| 反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| 选择性100%表示反应生成的产物是乙酸乙酯和水 |
根据表中数据,下列___(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h
C.60℃,4h D.40℃,3h











