-
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g)  2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);,使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);,使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)O2 (g)= O+2(g)+e-  H1=+ 1175.7 kJ·mol-1
H1=+ 1175.7 kJ·mol-1
 PtF6(g)+ e-1
PtF6(g)+ e-1  PtF6-(g)
PtF6-(g)  H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6-  H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
-
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂反应的△H________(填“增大”“减小”或“不改变”).
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂反应的△H________(填“增大”“减小”或“不改变”).
(2)O2 (g)=O+2(g)+e-△H1=+1175.7kJ•mol-1
PtF6(g)+e-1=PtF6-(g)△H2=-771.1kJ•mol-1
O2+PtF6-(s)=O2+(g)+PtF6-(g)△H3=+482.2kJ•mol-1
则反应O2(g)+PtF6(g)=O2+PtF6-(s)的△H=________kJ•mol-1.
(3)在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________,已知25℃时Ksp[Mg(OH)2] = 1.8 × 10-11,KsP[Cu(OH)2] = 2.2 × 10-20
(4)在25℃时,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”),用含a的代数式表示NH3•H2O的电离常数kb=________。
-
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H________(填“增大”、“减小”或“不改变”)。
2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H________(填“增大”、“减小”或“不改变”)。
(2)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出。
首先生成沉淀的离子方程式为__________________
氨水过量后,生成的沉淀会部分溶解,写出溶解沉淀的离子方程式__________________________.
( 已知25℃时Ksp[Mg(OH)2]=1.8×10-11, KsP[Cu(OH)2]=2.2×10-20 )
(3) 在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中
c(NH4+) = c(Cl-)。则溶液显_____ 性(填“酸”、“碱”或“中”),请用含a的代数式表示NH3·H2O的电离常数Kb=________。
(4) 在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则v(o2)=mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,再次达到平衡后, n(SO3)的取值范围为________________。
-
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g)⇌2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H________(填“增大”、“减小”或“不改变”).
(2)在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出.
首先生成沉淀的离子方程式为________氨水过量后,生成的沉淀会部分溶解,写出溶解沉淀的离子方程式________.
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)
(3)在25℃下,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应后溶液中
c(NH4+)=c(Cl-).则溶液显________性(填“酸”、“碱”或“中”),请用含a的代数式表示NH3•H2O的电离常数Kb=________.
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(o2)=________mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,再次达到平衡后,n(SO3)的取值范围为________.
-
运用化学反应原理对研究部分单质及其化合物的反应有重要意义。
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g) 2NH3(g)。请回答:
2NH3(g)。请回答:
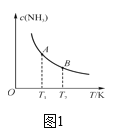
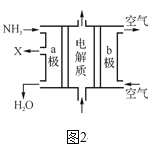
①已知H—H键键能为436kJ·mol-1,N≡N键键能为945 kJ·mol-1,N—H键键能为391 kJ·mol-1。由键能计算消耗1 mol N2时的ΔH=_____。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡____(填“向左”、“向右”或“不”)移动。
②如图中,当温度由T1变化到T2时,KA___(填“>”、“<”或“=”)KB。
③废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作____(填“正”、“负”、“阴”或“阳”)极,其电极反应式为____。
(2)某温度下在容积固定的密闭容器中,下列反应达到平衡:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
| 起始n(CO)∶n(H2O) | CO转化率 | H2O转化率 |
| 1∶1 | 0.5 | 0.5 |
| 1∶2 | 0.67 | 0.33 |
| 1∶3 | 0.75 | 0.25 |
①该反应的平衡常数为_____。该温度下,向容器中充入1 mol CO、3 mol H2O、2 mol CO2、1.5 mol H2,则起始时该反应速率v(正)______(填“>”、“<”或“=”)v(逆)。
②结合表中数据,判断下列说法正确的是_______(填字母)。
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同,二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的量之比为1∶4时,CO的转化率为0.85
③该温度下,向容器中充入2 mol CO、2 mol H2O,达平衡时放出a kJ热量,则该反应的ΔH=_____。
-
(10分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-  H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)  H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)  H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的  H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)已知:2NO2(g)  N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)
N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g) N2O4(g)达到平衡。写出该反应的平衡常数表达式: ________ ,升高温度,该反应的平衡常数K值将 ________(填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是________(填字母序号)
N2O4(g)达到平衡。写出该反应的平衡常数表达式: ________ ,升高温度,该反应的平衡常数K值将 ________(填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是________(填字母序号)
 A.减小NO2的浓度 B.降低温度 C.增加NO2的物质的量 D.升高温度
A.减小NO2的浓度 B.降低温度 C.增加NO2的物质的量 D.升高温度
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
-
(16分)
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂________反应的△H(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂________反应的△H(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-  H1= + 1175.7 kJ·mol-1
H1= + 1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)  H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)  H3= + 482.2 kJ·mol-1
H3= + 482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 H=_____________ 。
H=_____________ 。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为
________________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显________性(填“酸”、“碱”或“中”)高
-
(9分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-  H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)  H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)  H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的  H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中
c(NH4+)=c(Cl-)。则溶液显________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
-
(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2 (g) + O2(g) = 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g) = 2CO2 (g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式。
(3)在25℃下,向浓度为0.1 mol·L-1的AlCl3溶液中逐滴加入氨水,生成该沉淀的离子方程式为______________________________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式________。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为中性,则
Va︰Vb= 。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
-
(10分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-  H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)  H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)  H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的  H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)已知:2NO2(g)  N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)
N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g) N2O4(g)达到平衡。写出该反应的平衡常数表达式: ________ ,升高温度,该反应的平衡常数K值将 ________(填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是________(填字母序号)
N2O4(g)达到平衡。写出该反应的平衡常数表达式: ________ ,升高温度,该反应的平衡常数K值将 ________(填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是________(填字母序号)
 A.减小NO2的浓度 B.降低温度 C.增加NO2的物质的量 D.升高温度
A.减小NO2的浓度 B.降低温度 C.增加NO2的物质的量 D.升高温度
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H________(填“增大”、“减小”或“不改变”)。

