-
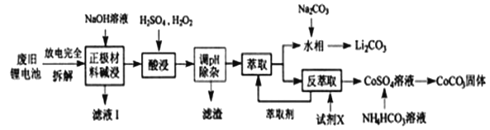
钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。
几种金属离子沉淀完全(离子浓度为10-5mo/L) 的pH如下表:
| 离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)滤液I的主要成分是_________。
(2)已知: 氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是________不能用盐酸代替硫酸,原因是:__________。“调节pH”除去的离子主要有Al3+和_____。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是_________。

(4)“萃取”和“反萃取“可简单表示为: Co2++2( HA)2 Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________。
Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为_________。
-
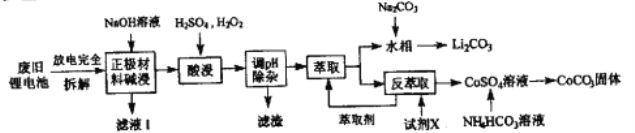
钻酸锂电池成用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑。铝箔及少量Fe,可通过下列实验方法回收钴、锂。
几种金属离子沉淀完全(离子浓度为10-5mol/L)的pH如下表:
| 离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)LiCoO2中,Co 元素的化合价为_______,滤液I的主要成分是______。
(2)已知: 氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是______。“调节pH”除去的离子主要有Al3+和____。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是________。

(4)“萃取”和“反萃取“可简单表示为: Co2++2(HA)2  Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为__________。
-
废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂.
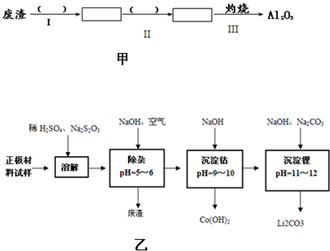
(1)在上述溶解过程中,S2O32ˉ被氧化成SO42ˉ,LiCoO2在溶解过程中反应的离子方程式为______.
| 沉淀物 | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 3.0 | 5.2 |
| Fe(OH)3 | 1.5 | 2.8 |
| Fe(OH)2 | 7.6 | 9.7 |
(2)除杂时通入空气的目的______,所得的废渣成分为______.从废渣中获得Al2O3的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有______,步骤Ⅱ中反应的离子方程式是______.
(3)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如图乙.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阴极的电极反应式是______.
②b中,生成Li2CO3反应的化学方程式是______.
-
钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
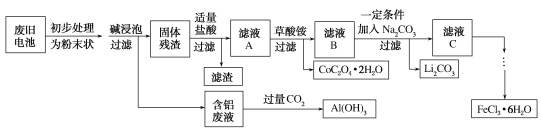
已知:还原性:Cl−>Co2+;
回答下列问题:
(1)废旧电池初步处理为粉末状的目的是___________。
(2)从含铝废液得到Al(OH)3的离子方程式为________。
(3)滤液A中的溶质除HCl、LiCl外还有FeCl3、CoCl2。写出LiCoO2和盐酸反应的化学方程式_______。
(4)滤渣的主要成分为______(填化学式)。
(5)已知Li2CO3的溶度积常数Ksp=8.64×10−4,将浓度为0.02mol·L−1的Li2SO4和浓度为0.02 mol·L−1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L−1。
(6)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是________。
-
某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
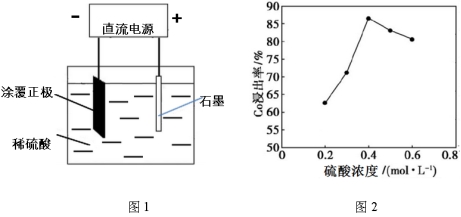
阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。
阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol/L时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式: 。该步骤一般在80℃以下进行,温度不能太高的原因是 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
B.c(H+)+c(NH4+)=c(C2O42-)+c(OH-)+c(HC2O42-)
C.c(NH4+)+c(NH3·H2O)=2[c(C2O42-)+c(HC2O42-)+c(H2C2O4)]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2 的质量分数为a%,则回收后得到CoC2O4·2H2O 的质量不高于 g。
-
LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
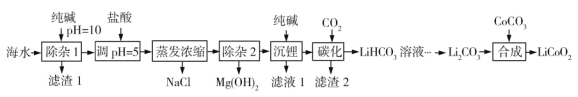
已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
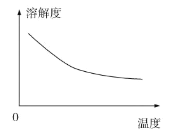
②碳酸锂的溶解度与温度关系如图所示:
③常温下,几种难溶物质的溶度积数据如下:
| 物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
| Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
| 序号 | 
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
| ① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
| ② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
| ③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
| ④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。
-
锂离子电池的正极材料是含锂的钴酸锂(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,用LiC6表示。电池反应为CoO2+LiC6 LiCoO2+C6,下列说法正确的是( )
LiCoO2+C6,下列说法正确的是( )
A.充电时,电池的负极反应为LiC6-e-=Li++C6
B.放电时,电池的正极反应为CoO2+Li++e-=LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
-
锂离子电池的广泛应用使得锂电池的回收利用一直是科学家关注的焦点。磷酸铁锂是锂电池中最有前景的正极材料,磷酸铁是其前驱体,充放电时可以实现相互转化。某研究性小组对废旧锂离子电池正极材料(图中简称废料,成份为LiFePO4、碳粉和铝箔)进行金属资源回收研究,设计实验流程如下:
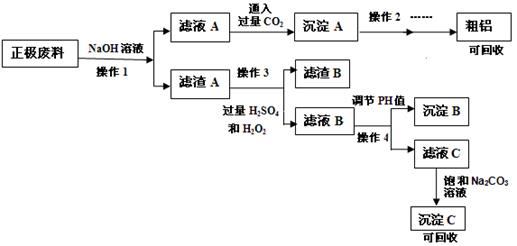
已知:① FePO4可溶于稀H2SO4,不溶于水和其他的酸。
② Li2SO4、LiOH和Li2CO3在273K下的溶解度分别为34.2g、22.7g和1.54g,
在373K下,Li2CO3的溶解度为0.72g
③ Ksp[Al(OH)3]=10-32 Ksp[Fe(OH)3]=4×10-38
(1)操作1为: 。
(2)滤液A中通入过量CO2的化学方程式为: 。
(3)可以提高操作1浸出率的方法有(写出3种) 。
(4)完成操作3中的离子方程式: 。
(5)该锂电池充电时的阳极反应式: 。
(6)操作4中应选择试剂: 。
(7)沉淀C的成分: 。
-
锰酸锂(LiMn2O4)可作为锂离子电池的正极材料。工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如下:
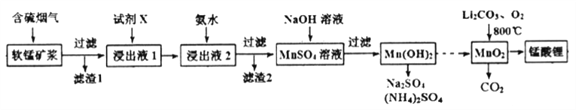
已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质。
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
③部分氢氧化物沉淀相关的溶液pH如下表:
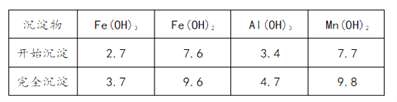
(1)已知:
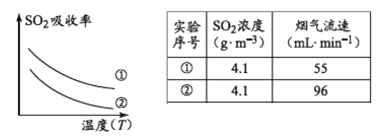
下列措施可提高SO2吸收率的是__________(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是_____________(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是_______________。
(4)锰酸锂可充电电池的总反应式为:Li1-xMnO2+LixC  LiMn2O4+C(x<1)
LiMn2O4+C(x<1)
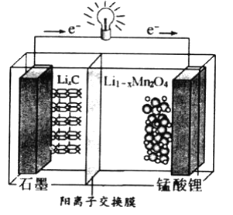
①放电时,电池的正极反应式为__________________
②充电时,若转移1mole-,则石墨电极将增重__________g。
-
锂离子电池广泛用作便携式电源,其正极材料是决定锂离子电池可逆容量与循环寿命的关键因素之一。锂二次电池一般以LiCoO2、LiFePO4等为正极材料,以石墨碳为负极材料,以溶有LPF6、LiBF4等的碳酸二乙酯(DEC) 为电解液。充电时,Li+ 从正极层状氧化物的晶格间脱出进入有机电解液,有机电解液中的Li+则进入负极,得电子后以原子形式嵌入到石墨材料的晶格中,即: 6C+xLi++xe-=LixC6,如图所示:

(1)如图所示,已知该电池电极总反应:LiCoO2+C Li1-xCoO2+CLix,充电时,该电池的正极上的反应为_______________________。
Li1-xCoO2+CLix,充电时,该电池的正极上的反应为_______________________。
(2)放电时负极材料质量________(填“增加”、“减小”或“不变”)
(3)在实验室中,可用下列方案从废旧锂离子电池的正极材料中(主要含有LiCoO2、炭粉及少量Al、Fe等) 回收钴和锂。

①溶解过程中,通入SO2时所发生反应的化学方程式为________________________;
②除杂过程中,所得沉淀的主要成分是___________________;(写化学式)
③常温下,已知Ksp[Co(OH)2]=1.09×10-15,若沉淀钴时pH=9.5,则溶液中Co2+是否沉淀完全? 请列式计算说明。 _______________________________________________。


Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________。


 Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。











