-
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 
②CO(g)+H2O(g)=CO2(g)+H2(g) 
写出由二氧化碳、氢气制备甲醇的热化学方程式________;
(2)在压强0.1MPa条件下,容积为 VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。

①P1________P2(填大于、小于或等于);
②在其它条件不变的情况下,再增加 amolCO与2amolH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”,下 同),平衡常数________。
(3)以甲醇为燃料的新型燃料电池,正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:CH3OH+H2O-6e-=CO2+6H+
①正极的电极反应式是________;放电时,H+移向电池的________(填“正”或“负”)极。
②若以该燃料电池作为电源,用石墨作电极电解500mL饱和食盐水,当两极共收集到标准状况下的气体1.12L(不考虑气体的溶解)时,所得溶液的pH=________(假设反应前后溶液体积不变)。
-
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)己知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g)== CO2(g) +H2(g) ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式______________;
(2)在一定条件下,某密闭容器中进行上述二氧化碳与氢气制备甲醇的反应,反应过程中部分数据如下表:
| 反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 恒温恒容 (T1℃、2L) | Omin | 2 | 6 | 0 | 0 |
| 10min | | 4.5 | | |
| 20min | 1 | | | |
| 30min | | | 1 | |
①0〜l0min内,用H2O(g)表示的化学反应速率v(H2O)=__mol/(L·s)
②达到平衡时,该反应的平衡常数K=____(用分数表示),平衡时H2的转化率是____。
③在其它条件不变的情况下,若30min时改变温度为T2℃,此时H2的物质的量为3.2mol,则T1___T2(填“>”、“<”或“=”),理由是_____。在其他条件不变的情况下,若30min时向容器中再充入lmolCO2 (g)和lmolH2O (g),则平衡____移动(填“正向”、“逆向”或“不”)。
(3)以甲醇为燃料的新型燃料电池,正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。
①负极的电极反应式是________________;
②若以该燃料电池作为电源,用石墨作电极电解500mL饱和食盐水,当两极共收集到标准状况下的气体1.12L (不考虑气体的溶解)时,所得溶液的pH=____ (假设反应前后溶液体积不变)。
-
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
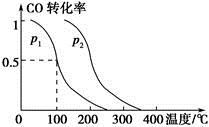
①p1________p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”,下同),平衡常数________。
(3)已知在T ℃时,CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
此时刻v正________v逆(填“>”或“<”)。
-
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
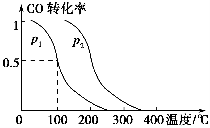
①p1________p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”,下同),平衡常数________。
(3)已知在T ℃时,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是___________________________________________。此时刻v正________v逆(填“>”或“<”)。
-
能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
Ⅰ、已知在常温常压下:① H2O(I)=H2O(g) △H= +44.0 kJ.mol-1
② 2CH3OH(I)十3O2(g)=2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
写出表示甲醇燃烧热的热化学方程式 。
Ⅱ、工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
反应B:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
在体积为2L的合成塔中,充人2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化及甲醇的物质的量随时间、温度变化如下图所示。(T1、T2均大于300℃)
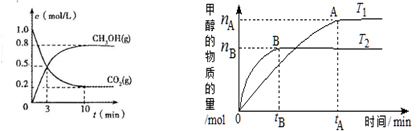
(1) 则上述CO2转化为甲醇的反应的△H1___ _0(填“>”“<”或“=”)。
(2)从反应开始到平衡(10min),用H2表示 的反应速率为__________;
(3)下列说法正确的是 。
A.若保持恒温,当容器中n(CH 3OH)︰n(H2O)为1︰1时,该反应已达平衡状态
B.若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态
C.若其他条件不变,则平衡常数:K(T1)<K (T2)
D.处于A点的反应体系的温度从T1变到T2,达到平衡时 增大
增大
(4)对于反应A,若容器容积不变,下列措施可增加甲醇产率的是 。
A.增加CO2的量 B.升高温度
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
(5)某温度下,将4mol CO和12mol H2,充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.5 mol·L—1,,则该温度下该反应的平衡常数为 。
(6)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为A,则容器内的压强与起始压强之比为_____ ___。
-
能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
② H2O(l) H2O(g) △H=+ 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式。
(2)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
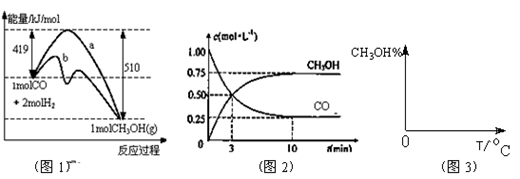
①在“图1”中,曲线________(填“a”或“b”)表示使用了催化剂。
②能判断该反应在“图2”所在条件下是否已达化学平衡状态的依据是________。(双选)
A.容器中压强不变 B.体系的密度不随时间改变
C.v正(H2)=2v逆(CH3OH) D.CO与H2的物质的量的比不随时间改变
③计算该温度下CO(g)+2H2(g) CH3OH(g)的化学平衡常数K=________ 。
CH3OH(g)的化学平衡常数K=________ 。
④请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(3)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6。现将c mol·L-1 CaCl2溶液与2.00×10-2 mol·L-1 Na2SO4溶液等体积混合生成沉淀,则c的最小值是 ________(结果保留3位有效数字)。
-
能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=_1275.6kJ•mol-1
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
写出表示甲醇燃烧热的热化学方程式:______.
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1
反应B:CO(g)+2H2(g)⇌CH3OH(g)△H2
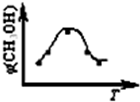
取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的△H1______0(填“>”、“<”或“=”).
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是______.
A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
③某温度下,将4mol CO和12mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.5mol•L-1,则该温度下该反应的平衡常数为______.
④.某种甲醇-空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液.其工作时负极的电极反应式可表示为______
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1:1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥,则该反应的化学方程式为______.
(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)______ c(NO3-)+c(OH-)(填写“>”“=”或“<”)
-
能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=_1275.6kJ•mol-1
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
写出表示甲醇燃烧热的热化学方程式:______.
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1
反应B:CO(g)+2H2(g)⇌CH3OH(g)△H2
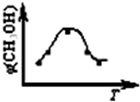
取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的△H1______0(填“>”、“<”或“=”).
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是______.
A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
③某温度下,将4mol CO和12mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.5mol•L-1,则该温度下该反应的平衡常数为______.
④.某种甲醇-空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液.其工作时负极的电极反应式可表示为______
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1:1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥,则该反应的化学方程式为______.
(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)______ c(NO3-)+c(OH-)(填写“>”“=”或“<”)
-
(15分)能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(I)十3O2(g) 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol—1
②H2O(I) === H2O(g) △H=+ 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式________(2分).
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
反应B:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如下图所示,
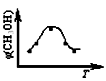
则上述CO2转化为甲醇的反应的
△H1________0(填“>”、“<”或“=”)。(2分)
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是________(2分)。
A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
③某温度下,将4mol CO和12mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.5 mol·L—1,,则该温度下该反应的平衡常数为________(2分)。
④.某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为______________________________(2分)
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1∶1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。,则该反应的化学方程式为________ 。(3分)
(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则
溶液中c(Na+)+c(H+)_____ c(NO3-)+c(OH-)(填写“>”“=”或“<”)(2分)
-
(15分)能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(I)十3O2(g) 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol—1
②H2O(I) === H2O(g) △H=+ 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式________(2分).
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
反应B:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如下图所示,则上述CO2转化为甲醇的反应的△H1________0(填“>”、“<”或“=”)。(2分)
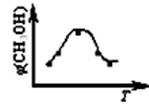
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是________(2分)。
A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
③某温度下,将4mol CO和12mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.5 mol·L—1,,则该温度下该反应的平衡常数为________(2分)。
④.某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为______________________________(2分)
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1∶1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。,则该反应的化学方程式为________ 。(3分)(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则
溶液中c(Na+)+c(H+)_____ c(NO3-)+c(OH-)(填写“>”“=”或“<”)(2分)
CH3OH(g) ΔH1=-90 kJ·mol-1








