-
甲同学进行了FeCl2溶液的配制、浓度的测定以及Fe2+还原性的实验,并针对异常现象进行探究。
步骤一:制取FeCl2甲同学准备用两种方案制取。
方案1:按下图装置用H2还原无水FeCl3制取。

E中盛放的试剂是____________;D中反应的化学方程式为____________。此方案有个明显的缺陷是___________________________。
方案2:由0.1 mol•L-1 FeCl3溶液制取FeCl2溶液,你认为其操作应该是____________ 。
步骤二:测定方案2所配FeCl2溶液的物质的量浓度。用重铬酸钾法(一种氧化还原滴定法)可达到目的。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液480 mL,实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少_______________,
本实验滴定过程中操作滴定管的图示正确的是____________(填编号)。

下列错误的操作使测定的FeCl2 溶液浓度偏小的是______________。
A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势
B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失。
C.锥形瓶洗净后未干燥
步骤三:向2 mL FeCl2溶液中滴加2滴0.1 mol·L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
甲同学探究“步骤三”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀,并测得生成了两种可直接排放到空气中的气体。
实验III.向2 mL 0.1 mol·L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
①实验I说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应。
②实验III的目的是_____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-和相关气体。写出该反应的离子方程式_______________________。
-
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液.向0.1mol·L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
实验二:向2mL FeCl2溶液中滴加2滴0.1mol·L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:________________。
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
Ⅲ.向2mL 0.1mol·L-1 FeCl3溶液中滴加2滴0.1mol·L-1KSCN溶液,变红,通入O2,无明显变化。
①实验I的说明__________________;
②实验Ⅲ的目的是____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)①甲直接用FeCl2·4H2O配制_________mol·L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去,进一步探究其原因:
②.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH约为3.由此,乙认为红色不褪去的可能原因是:____________________。
③.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1mol·L-1 FeCl3溶液 | |
-
(16分)
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | ③ | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 | ④ |
-
(16分)
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | ③ | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 | ④ |
-
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;
实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH约为3。由此,乙认为红色不褪去的可能原因是 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 | |
-
下列实验操作中,对应的现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向较浓的FeCl2溶液中滴入少量酸性KMnO4溶液 | KMnO4溶液紫色褪去 | Fe2+有还原性 |
| B | 用pH试纸分别测定等浓度的NaClO和NaHCO3溶液的pH | pH:NaClO> NaHCO3 | 酸性H2CO3>HClO |
| C | 向Na2SiO3溶液中通入足量的CO2 | 产生白色胶状物质 | 非金属性:C>Si |
| D | 向2mL1mol·L-1的NaOH溶液中滴加5滴1mol·L-1MgCl2溶液,再滴加5滴1mol·L-1的FeCl3溶液 | 先产生白色沉淀后又产生红褐色沉淀 | 溶度积常数:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
-
某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下:
Ⅰ. 配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉。
Ⅱ. 实验探究Fe3+与Fe2+相互转化
实验1:
0.1 mol/L FeCl2溶液 无明显现象
无明显现象 溶液变红
溶液变红
实验2:
0.1 mol/L FeCl3溶液 溶液变红
溶液变红 溶液红色未褪去
溶液红色未褪去
写出Fe(OH)2Cl与盐酸反应的离子方程式________。
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因________。
(3)实验2的现象与预测不同, 为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10 mL 0.1 mol/L KI溶液 溶液明显变黄
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2 mL黄色溶液 溶液变红
溶液变红
试管2 取3 mL黄色溶液 溶液变蓝
溶液变蓝
试管3 取3 mL黄色溶液 取上层溶液
取上层溶液 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
① 试管2中滴加K3[Fe(CN)6] 检验的离子是________。
② 黄色溶液中含有的溶质微粒有K+ 、Cl- 和________。
③ 综合上述实验现象,得出的实验结论是________。
-
某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
| 编号 | 实验I | 实验II | 实验III |
| 实验步骤 | 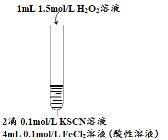
| 将实验I褪色后的溶液分三份分别进行实验 
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
| 现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
-
某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
| 编号 | 实验I | 实验II | 实验III |
| 实验步骤 | 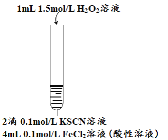
| 将实验I褪色后的溶液分三份分别进行实验 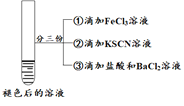
| 为进一步探究“红色褪去”的原因,又进行以下实验 ①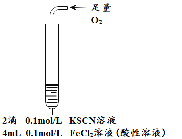 ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
| 现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
-
(15分)3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析。
(1)甲用湿润的KI-淀粉试纸检验上述生成的气体,观察到试纸变蓝,据此判断氧气中混有Cl2。用离子方程式解释甲判断试纸变蓝的原因 。
(2)乙认为上述现象只能说明混合气体具有 性,实验中使试纸变蓝的气体单质还可能是 。为了进一步验证甲的推测,乙补充了一个实验:将上述生成的气体冷却后通入盛有 溶液的洗气瓶中,若现象为 ,则甲的推测合理 。
(3)丙查阅文献获知,这种方法制取氧气的过程中确有Cl2产生,并且查到了以下反应历程:
①2KClO3 + 2MnO2 → 2KMnO4 + Cl2 + O2↑
② 反应②
③K2MnO4 + Cl2 → 2KCl + MnO2 + O2↑
总反应 2KClO3→2KCl + 3O2↑
丙设计实验,通过观察MnO4-的特征颜色来验证反应历程中①的发生,具体实验操作为:将一定量的KClO3 和MnO2混合于试管中,加热, 。写出历程中反应②的化学方程式 。
(4)另据文献记载:此法制取的氧气中除了含有Cl2,还混有化合物ClO2。ClO2具有强氧化性,可以将污水中的S2-氧化成SO42-,反应的离子方程式为 。







