-
2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)⇌2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,该反应的速率υ(NO)为______;计算该条件下的平衡常数______.
(2)恒温恒容,能说明反应 2NO(g)⇌N2(g)+O2(g) 达到平衡的是______(填代号).
A.单位时间内消耗2mol NO,同时消耗1mol N2
B.NO、N2、O2的浓度之比为2:1:1
C.N2的浓度不再发生变化
D.容器内气体密度不再发生变化
(3)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为:______.
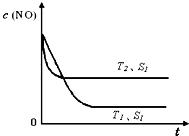
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图是反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g) 中NO的浓
度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H______0 (填“>”、“<”或“无法确定”).若催化剂的表面积S1>S2,在图中画出NO的浓度在T1、S2条件下达到平衡过程中的变化曲线,并注明条件.
-
(10分)近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
 (1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示。(已知: )
)

 ①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热) 反应。
①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热) 反应。
 ②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是(填序号) 。
②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是(填序号) 。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NO2消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)=CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1
△H2= .
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 。
-
(10分)近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示。(已知: )
)

①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热) 反应。
N2(g)+O2(g)为(填“吸热”或“放热) 反应。
②一定温度下,能够说明反应 2NO(g) N2(g)+O2(g)已达到平衡的是(填序号) 。
N2(g)+O2(g)已达到平衡的是(填序号) 。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用 CxHy(烃)催化还原NO2消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)=CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1,
△H2= .
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 。
-
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:
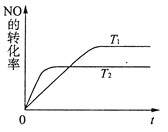
(1)汽车发动机工作时会引起反应:N2(g)+O2(g)  2NO(g),是导致汽车尾气中含有NO的原因之一。一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。
2NO(g),是导致汽车尾气中含有NO的原因之一。一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。
①反应2NO(g)  N2(g)+O2(g)为________反应(填“吸热”或“放热”);
N2(g)+O2(g)为________反应(填“吸热”或“放热”);
②一定温度下,能够说明反应2NO(g)  N2(g)+O2(g)已达到平衡的是______(填序号);
N2(g)+O2(g)已达到平衡的是______(填序号);
a.容器内的压强不发生变化 b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变 d.单位时间内分解4 mol NO,同时生成2 mol N2
(2)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)=== 4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mo1-1
写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:______________________;
(3)大气污染物氮氧化物可以用活性炭还原法处理。某研究小组向某0.5L的密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间测得各物质的物质的量如下:
N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间测得各物质的物质的量如下:
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.32 | 0.32 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.34 | 0.34 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.17 | 0.17 |
①0~10min内,NO的平均反应速率v(NO)=________________;T1℃时,该反应的平衡常数K=___________________________;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________(填字母编号)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
f.移出一定量的CO2
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则 ∆H_________0(填“>”或“<”或“=”)。
-
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。
(1)汽车内燃机工作时发生反应:N2(g) + O2(g)  2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
① 5 min内该反应的平均速率υ(NO) = ________;在T ℃时,该反应的平衡常数K = ________。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是________(填序号)。
a. 混合气体的密度 b. 混合气体的压强
c. 正反应速率 d. 单位时间内,N2和NO的消耗量之比
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g) + O2(g) = 2NO(g) ?H =" +180.5" kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ?H = -571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是________。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g) 2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的?H________0 (填“>”或“<”)。
② 若催化剂的表面积S1>S2 ,在下图中画出c(NO) 在T1、 S2 条件下达到平衡过程中的变化曲线。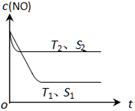
-
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物显得尤为重要。
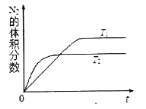
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g)  2NO(g)的△H______0(填“>”或“<”)。
2NO(g)的△H______0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ (N2)=_______________。该温度下,若增大压强此反应的平衡常数将______(填“增大”“减小”“不变”“无法确定”)若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
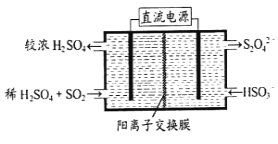
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将含a molCH3COOH的醋酸溶液与含b molBa(OH)2的氢氧化钡溶液混合,充分反应后,溶液呈中性,则醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
-
汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应:N2(g) + O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
(1)已知H2或CO可以催化还原NO以达到消除污染的目的。N2(g) + O2(g) = 2NO(g) △H= +180.5 kJ·mol-1,2H2(g) + O2(g) = 2H2O(l) △H=-571.6 kJ·mol-1,则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是_________________________,判断该反应自发进行的条件:_______________(填“高温自发”或“低温自发”)。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g) 2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
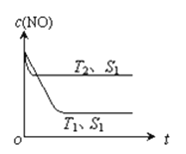
①则该反应的△H___0(填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在该图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线___。
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.
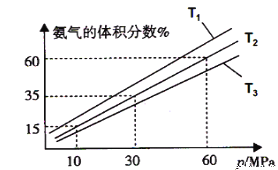
①能判断N2(g)+3H2(g)⇌2NH3(g)达到平衡的是___(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②此时N2的平衡分压为_________MPa.(分压=总压×物质的量分数)。计算出此时的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,结果保留2位有效数字)。
-
汽车内燃机工作时产生的高温会引起N2和O2发生反应:N2(g)+O2(g) 2NO(g),这是汽车尾气中含有NO的原因之一。某同学为探究控制污染的方法,对该反应进行研究。
2NO(g),这是汽车尾气中含有NO的原因之一。某同学为探究控制污染的方法,对该反应进行研究。
(1)如图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象。

①达到平衡后反应速率v1(T1条件下)________v2(T2条件下)(填“>”、“<”或“=”)。
②N2(g)+O2(g) 2NO(g)为________(填“吸热”或“放热”)反应。
2NO(g)为________(填“吸热”或“放热”)反应。
(2)为避免汽车尾气中的有害气体对大气造成污染,应给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,写出CO、NO在催化剂作用下转化为无害气体的化学方程式:________
-
氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
(1) 已知:N2(g)+2O2(g) 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
则N2(g)+O2(g) 2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
(2) 若反应N2(g)+O2(g) 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
(3) 汽车尾气净化反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
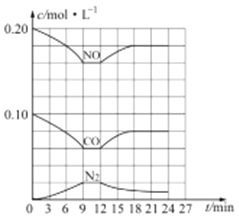
①该反应能自发进行的条件为_____ (填“高温”、“低温”或“任意温度”);
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=________mol·L-l·min-1;
③第12min时改变的反应条件为_________ (填“升高温度”或“降低温度”);
④反应在第24min时的平衡常数K=____________(只列出计算式,无需计算结果),若保持温度不变,再向容器中充入CO、N2 各0.060mol,平衡将_________移动(填“正向”、“逆向”或“不”)。
-
氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
(1) 已知:N2(g)+2O2(g) 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
则N2(g)+O2(g) 2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
(2) 若反应N2(g)+O2(g) 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
(3) 汽车尾气净化反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:

①该反应能自发进行的条件为_____ (填“高温”、“低温”或“任意温度”);
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=________mol·L-l·min-1;
③第12min时改变的反应条件为_________ (填“升高温度”或“降低温度”);
④反应在第24min时的平衡常数K=____________(只列出计算式,无需计算结果),若保持温度不变,再向容器中充入CO、N2 各0.060mol,平衡将_________移动(填“正向”、“逆向”或“不”)。











