-
煤制备CH4是一种有发展前景的新技术。
I. 煤炭气化并制备CH4包括以下反应:
C(s)+H2O(g)=CO(g)+H2 (g) ΔH 1 = +131 kJ/mol
CO(g) + H2O(g)=CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol
CO(g) + 3H2 (g)=CH4 (g)+ H2O(g) ΔH 3 = −206 kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式 。
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有 。
(3)写出甲烷—空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式 。
II. 对以上反应CO(g) + H2O(g)  CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
| 实验编号 | 容器体积/L | 温度/°C |
| ① | 2.0 | 1200 |
| ② | 2.0 | 1300 |
| ③ | 1.0 | 1200 |
(1)实验①中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,画出实验②和③中c(CO2)随时间变化关系的预期结果示意图。
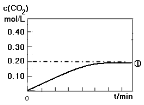
(2)在与实验①相同的条件下,起始时充入容器的物质的量:n(CO)=n(H2O)=n(CO2) =n( H2)=1.00mol。通过计算,判断出反应进行的方向。(写出计算过程。)
-
煤炭气化作为洁净煤利用的核心技术,是影响煤化工系统效率、污染物及温室气体排放的关键。工业生产中主要的气化方式包括纯水气化、CO2气化和纯氧气化,反应如下:
i.C(s)+H2O(g) CO(g)+H2(g) ΔH=+119kJ·mol-1
CO(g)+H2(g) ΔH=+119kJ·mol-1
ii.C(s)+CO2(g) 2CO(g) ΔH=+162kJ·mol-1
2CO(g) ΔH=+162kJ·mol-1
iii.C(s)+ O2(g)
O2(g) CO(g) ΔH=-123kJ·mol-1
CO(g) ΔH=-123kJ·mol-1
iv.C(s)+ O2(g) CO2(g) ΔH=-409kJ·mol-1
CO2(g) ΔH=-409kJ·mol-1
(1)均相水煤气反应CO(g)+H2O(g) H2(g)+CO2(g)的ΔH__。
H2(g)+CO2(g)的ΔH__。
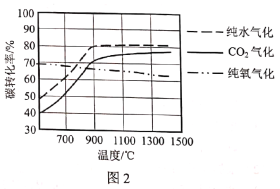
(2)图1是不同气化方式得到的合成气成分,图2是温度对碳转化率的影响(碳转化率是指气化得到气体中的碳占入炉原料煤中碳的质量分数)。
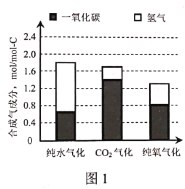
①气化过程中不同氧化剂的配比会对合成气的成分造成很大影响,为了提高合成气的氢碳比,生产中应该适当提高__在氧化剂中的比例。
②若使用混合氧化剂进行气化,最佳气化温度是___℃。温度升高纯氧气化的碳转化率降低,原因是___。
③工业上常在压强200kPa的条件下进行气化,压强过高过低都不利于气化的进行,可能的原因是__。
④T℃时,向容积可变的恒压密闭容器中加入20g燃煤(含碳84%)和2molH2O(g)模拟纯水气化反应,起始容积为2L。一段时间达到平衡后,测得容器内H2为1mol。则该温度下C(s)+H2O(g) CO(g)+H2(g)的平衡常数K=__。
CO(g)+H2(g)的平衡常数K=__。
(3)煤的气化中可以利用CO2捕集技术实现CO2的综合利用。用石墨电极电解CO2制CH3CH2OH的原理示意图如图:
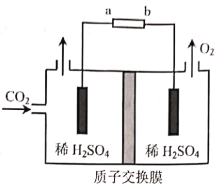
①b为电源的___(填“正”或“负”)极。
②生成CH3CH2OH的电极反应式为___。
-
(14分)煤炭气化可以提高燃料的利用率,又可以合成新型能源。
(1)煤炭气化时发生的反应为:C(s)+H2O(g) H2(g)+CO(g)。
H2(g)+CO(g)。
①已知:2C (s)+O2 (g)=2CO (g);△H1=–221.0 kJ mol–1
2H2 (g)+O2 (g)=2H2O (g);△H2=–483.6 kJ mol–1
则煤气化反应的△H=________。
②煤气化反应的平衡常数表达式K=________,温度升高,平衡常数________。
(2)水煤气可以合成甲醇:CO(g)+2H2(g) CH3OH(g)。一定条件下,向体积为1 L的密闭容器中充入1 mol CO和3 mol H2,反应达到平衡状态时,CO的平衡转化率为75%。
CH3OH(g)。一定条件下,向体积为1 L的密闭容器中充入1 mol CO和3 mol H2,反应达到平衡状态时,CO的平衡转化率为75%。
①从反应开始到平衡,H2的平均反应速率υ(H2)=________。
②反应达平衡后充入适量氢气并维持H2浓度和容器的温度不变,增大容器的体积,跟原平衡相比较达到新平衡时CO的转化率________(填“增大”、“不变”或“减小”),其原因是________。
③将3.2 g甲醇充分燃烧后的产物通入75 mL2 mol/L的NaOH溶液,所得溶液中离子浓度大小顺序为________。
-
淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
| n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
则从反应开始到2min时,用H2表示的反应速率为_________________;该温度下反应的平衡常数K=___________________(小数点后保留1位有效数字)。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol H2O(g)、2molCO2(g)、2mo1 H2(g),此时v正________v逆(填“>” “<” 或 “=”)。
Ⅱ.一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣105kJ•mol﹣1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如右图中Ⅰ、Ⅱ、Ⅲ曲线所示:

(1)Ⅱ和Ⅰ相比,改变的反应条件是______.
(2)反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=______.
(3)反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=______.
(4)比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________________________________________________________.
-
煤和甲烷既是重要的常用燃料,又是重要的化工原料。根据题意,回答下列问题:
I.煤制天然气过程中,存在多种化学反应,其中在煤气化装置中发生反应①:C(s) + H2O(g)=CO(g) + H2(g) ∆H = +135 kJ • mol-1 ,而在水气变换装置中发生反应②:CO(g)+H2O(g)=CO2(g)+ H2(g) ∆H =-41 kJ • mol-1
(1)煤气化前,需要通入一定量的氧气与碳发生燃烧反应,请利用平衡移动原理说明通入氧气的作用:_____________________
(2)写岀碳和二氧化碳反应生成一氧化碳的热化学方程式_____。
(3)如图表示发生反应①后进入反应②装置的n( H2O)/n(CO)与反应②中CO平衡转化率、温度的变化关系。
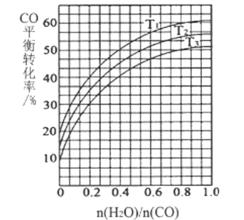
若n(H2O)/n(CO)为0.8,一定量的煤和水蒸气经反应①和反应②后,得到CO与H2的 物质的量之比为1:3,则反应②所对应的温度是_____(填“T1”、“T2”或“T3”)。
Ⅱ.甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和h2混合气体)。现在常(见的重整技术有甲烷——二氧化碳重整、甲烷——水蒸气重整,其反应分别为CH4(g)+3CO2(g)⇌2H2O(g)+4CO(g);CH4(g)+H2O(g)⇌CO(g)+3H2(g)
(4)甲烷——二氧化碳重整的催化转化原理如图所示:
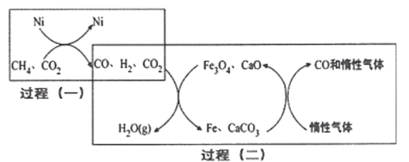
①过程(二)实现了含氢物种与含碳物种的分离,写出生成H2O(g)的化学方程式:______
②假设过程(一)和过程(二)中各步反应均转化完全,则下列说法正确的是_____ (填序号)。
a.过程(一)和过程(二)中均含有氧化还原反应
b.过程(二)中使用的催化剂为Fe3O4和CaCO3
C.若过程(一)投料比 ,可导致过程(二)中催化剂失效
,可导致过程(二)中催化剂失效
(5)通过计算机模拟甲烷——水蒸气重整实验测得,在操作压强为0.1Mpa、水碳比n(H2O)/n(CH4)为1.0,温度为900℃,反应达到平衡时,H2的物质的量分数为0.6。已知该反应的速率方程v=kP(CH4)·P-1(H2),式中k为速率常数,P为气体分压,气体分压=总压×气体物质的量分数,则此时该反应速率v=_____(用含k的式子表示);900℃时,该反应的压强平衡常数Kp=_____(用平衡分压代替平衡浓度计算)。
-
甲醇(CH3OH)的合成与应用具有广阔的发展前景。
Ⅰ.合成甲醇的部分工艺流程如下:

(1)甲烷与水蒸气反应制备合成甲醇的原料气CO、CO2和H2。CH4(g)+H2O(g)=CO(g)+3H2(g) 、∆H =+206.2 kJ·mol-1,CO(g) + H2O(g) =CO2(g) + H2(g)∆H =˗41.0 kJ·mol-1,甲烷与水蒸气反应生成CO2和H2的热化学方程式为________。
(2)在催化剂的作用下,200~300℃时,合成反应器内发生反应:ⅰ. CO(g)+2H2(g) CH3OH(g)∆H<0,ⅱ.CO2(g)+3H2(g)
CH3OH(g)∆H<0,ⅱ.CO2(g)+3H2(g) CH3OH(g) + H2O(g)∆H<0。
CH3OH(g) + H2O(g)∆H<0。
①一段时间内,记录合成反应器出、入口样品的温度,数据如图所示。曲线_________是合成反应器出口样品的温度。
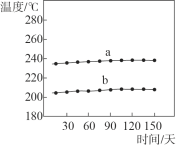
②如果你是工程师,请对合成反应器中压强的控制提出建议并说明理由:_______。合成反应器中有少量的副反应,会生成二甲醚(CH3OCH3)、甲酸甲酯等。已知沸点:甲醇 64.7℃;二甲醚 -24.9℃;甲酸甲酯32.0℃。
③CO和H2生成二甲醚的化学方程式是_________。
④从合成反应器出来的产品经分离提纯可以得到甲醇,请简述该方法_______。
Ⅱ.下图为甲醇燃料电池的示意图。
(3)①负极的电极反应式是_______。
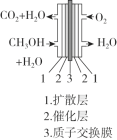
②质子交换膜材料的合成是燃料电池的核心技术。我国科研人员研发的一种质子交换膜材料的结构片段如下,它由三种单体缩聚而成。
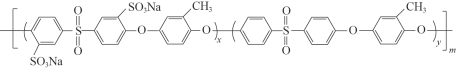
已知:ROH + R’Cl → R—O—R’ + HCl,单体的结构简式是: 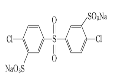 、 _____、___。
、 _____、___。
-
我省煤资源丰富,通过煤的气化和液化,能使煤炭得以更广泛的应用.
Ⅰ.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
| n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
则从反应开始到2min时,用H2表示的反应速率为 ;该温度下反应的平衡常数K= (小数点后保留1位有效数字).
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol H2O(g)、2molCO2(g)、2mo1H2(g),此时v正 v逆(填“>”“<”或“=”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol﹣1、286kJ•mol﹣1、726 kJ•mol﹣1.
(3)利用CO、H2合成液态甲醇的热化学方程式为 .
(4)依据化学反应原理,分析升高温度对制备甲醇反应的影响 .
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如右图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2﹣.

(5)以己烷(C6H14)代表汽油,写出该电池工作时的负极反应方程式 .
(6)用该电池电解1L饱和食盐水,当固体电解质中有0.05mol O2-发生迁移时,理论上,被电解的食盐水的pH=_______(忽略电解过程中溶液体积变化)
-
煤制合成天然气是煤气化的一种重要方法,其工艺核心是合成过程中的甲烷化,涉及的主要反应:
CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0 ①
CH4(g)+H2O(g) ΔH<0 ①
CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0 ②
CH4(g)+2H2O(g) ΔH<0 ②
现在300 ℃、容积为2 L的密闭容器中进行有关合成天然气的实验,相关数据记录如下:
| CO/mol | CO2/mol | H2/mol | CH4/mol | H2O/mol |
| 0 min | 4 | 3 | 40 | 0 | 0 |
| 30 min | 2 | 2 | a | 3 | |
| 70 min | 1 | b | c | d | 6 |
下列有关说法错误的是
A.a=30,b=1.5
B.c=25,d=4.5
C.前30 min内,反应①的平均反应速率v(CH4)=0.05 mol·L−1·min−1
D.后40 min内,反应②的平均反应速率v(H2)=0.025 mol·L−1·min−1
-
硝酸的工业制备包括氨的合成、氨的催化氧化及硝酸的浓缩等过程.完成下列计算:
(1)采用甲烷的二次转化法可以制备氢气.
第一次转化的化学方程式:CH4+H2O→CO+3H2;
第二次转化的化学方程式:2CO+CH4+2O2→3CO2+2H2;2CO+O2→2CO2.
现有标准状况下1m3的甲烷,若第一次转化80%,第二次转化20%,经过二次完全转化后可以得到H2__mol.
(2)用饱和K2CO3溶液吸收上述混合气体中的CO2以得到纯净的氢气.处理上述的CO2至少需要饱和K2CO3溶液____g.(已知:20℃K2CO3溶解度:110g/100g水)
(3)已知NH3+2O2→HNO3+H2O.现有氨气1.7吨,不补充水,理论上可制得硝酸的浓度为___%;在该硝酸中加入__吨水最终可得50%的硝酸.
(4)工业上常用98%的浓H2SO4作为制取浓HNO3的脱水剂.63.5%HNO3(质量为M1)中加98%的浓H2SO4(质量为M2)后蒸馏.分别得到97.7%的HNO3和49%的H2SO4溶液(不含HNO3).
①若蒸馏过程中HNO3、H2SO4、H2O均无损耗,求蒸馏前的投料比 的值__(列式计算).
的值__(列式计算).
②蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)×5.0%的H2O流失.则投料时, 比值如何变化,请列式计算说明__.
比值如何变化,请列式计算说明__.
-
硝酸的工业制备包括氨的合成、氨的催化氧化及硝酸的浓缩等过程.完成下列计算:
(1)采用甲烷的二次转化法可以制备氢气.
第一次转化的化学方程式:CH4+H2O→CO+3H2;
第二次转化的化学方程式:2CO+CH4+2O2→3CO2+2H2;2CO+O2→2CO2.
现有标准状况下1m3的甲烷,若第一次转化80%,第二次转化20%,经过二次完全转化后可以得到H2__mol.
(2)用饱和K2CO3溶液吸收上述混合气体中的CO2以得到纯净的氢气.处理上述的CO2至少需要饱和K2CO3溶液____g.(已知:20℃K2CO3溶解度:110g/100g水)
(3)已知NH3+2O2→HNO3+H2O.现有氨气1.7吨,不补充水,理论上可制得硝酸的浓度为___%;在该硝酸中加入__吨水最终可得50%的硝酸.
(4)工业上常用98%的浓H2SO4作为制取浓HNO3的脱水剂.63.5%HNO3(质量为M1)中加98%的浓H2SO4(质量为M2)后蒸馏.分别得到97.7%的HNO3和49%的H2SO4溶液(不含HNO3).
①若蒸馏过程中HNO3、H2SO4、H2O均无损耗,求蒸馏前的投料比 的值__(列式计算).
的值__(列式计算).
②蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)×5.0%的H2O流失.则投料时, 比值如何变化,请列式计算说明__.
比值如何变化,请列式计算说明__.
CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:










 、 _____、___。
、 _____、___。