-
煤和甲烷既是重要的常用燃料,又是重要的化工原料。根据题意,回答下列问题:
I.煤制天然气过程中,存在多种化学反应,其中在煤气化装置中发生反应①:C(s) + H2O(g)=CO(g) + H2(g) ∆H = +135 kJ • mol-1 ,而在水气变换装置中发生反应②:CO(g)+H2O(g)=CO2(g)+ H2(g) ∆H =-41 kJ • mol-1
(1)煤气化前,需要通入一定量的氧气与碳发生燃烧反应,请利用平衡移动原理说明通入氧气的作用:_____________________
(2)写岀碳和二氧化碳反应生成一氧化碳的热化学方程式_____。
(3)如图表示发生反应①后进入反应②装置的n( H2O)/n(CO)与反应②中CO平衡转化率、温度的变化关系。
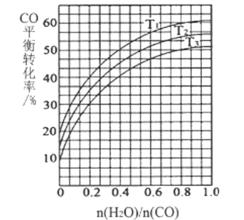
若n(H2O)/n(CO)为0.8,一定量的煤和水蒸气经反应①和反应②后,得到CO与H2的 物质的量之比为1:3,则反应②所对应的温度是_____(填“T1”、“T2”或“T3”)。
Ⅱ.甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和h2混合气体)。现在常(见的重整技术有甲烷——二氧化碳重整、甲烷——水蒸气重整,其反应分别为CH4(g)+3CO2(g)⇌2H2O(g)+4CO(g);CH4(g)+H2O(g)⇌CO(g)+3H2(g)
(4)甲烷——二氧化碳重整的催化转化原理如图所示:
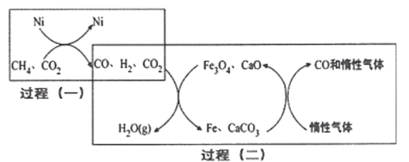
①过程(二)实现了含氢物种与含碳物种的分离,写出生成H2O(g)的化学方程式:______
②假设过程(一)和过程(二)中各步反应均转化完全,则下列说法正确的是_____ (填序号)。
a.过程(一)和过程(二)中均含有氧化还原反应
b.过程(二)中使用的催化剂为Fe3O4和CaCO3
C.若过程(一)投料比 ,可导致过程(二)中催化剂失效
,可导致过程(二)中催化剂失效
(5)通过计算机模拟甲烷——水蒸气重整实验测得,在操作压强为0.1Mpa、水碳比n(H2O)/n(CH4)为1.0,温度为900℃,反应达到平衡时,H2的物质的量分数为0.6。已知该反应的速率方程v=kP(CH4)·P-1(H2),式中k为速率常数,P为气体分压,气体分压=总压×气体物质的量分数,则此时该反应速率v=_____(用含k的式子表示);900℃时,该反应的压强平衡常数Kp=_____(用平衡分压代替平衡浓度计算)。
-
化学与生活密切相关。 下列叙述错误的是
A.疫苗因未冷藏储运而失效,与蛋白质变性有关
B.天然气既是高效清洁的化石燃料,又是重要的化工原料
C.“中国天眼”的镜片材料为SiC,属于新型有机非金属材料
D.港珠澳大桥水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
-
合成气(CO、H2)是一种重要的化工原料气。合成气制取有多种方法,如煤的气化、天然气部分氧化等。回答下列问题:
I.合成气的制取
(1)煤的气化制取合成气。
已知:①H2O(g)=H2O(l) △H=-44kJ/mol;
②部分物质的燃烧热:

则反应C(s)+H2O(g)=CO(g)+H2(g)的△H=___________kJ/mol。
(2)天然气部分氧化制取合成气。
如果用O2(g)、H2O(g)、CO2(g)混合物氧化CH4(g),欲使制得的合成气中CO和H2的物质的量之比为1︰2,则原混合物中H2O(g)与CO2(g)的物质的量之比为___________。
Ⅱ.利用合成气合成乙醇
在一定条件下,向容积为2L的恒容密闭容器中投入2 mol CO和4molH2,发生反应:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)。
CH3CH2OH(g)+H2O(g)。
(1)写出该反应的平衡常数表达式___________。
(2)下列情况能作为判断反应体系达到平衡的标志是___________(填序号)。
a.压强不再变化 b.平均摩尔质量不再变化 c.密度不再变化
(3)反应起始压强记为p1、平衡后记为p2,平衡时H2的转化率为___________。(用含p1、p2的代数式表示)
Ⅲ.合成乙醇的条件选择
为探究合成气制取乙醇的适宜条件,某科研团队对不同温度、不同Rh质量分数的催化剂对CO的吸附强度进行了研究,实验数据如图。CO的非离解吸附是指CO尚未乙醇化,离解吸附是指CO已经乙醇化。
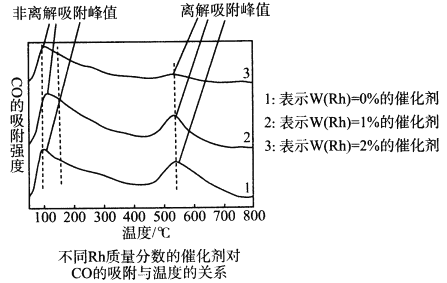
由此可见催化剂温度对CO吸附强度的影响是___________;用Rh作催化剂,合成气制取乙醇的适宜温度是___________。
-
甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护.请回答下列问题:(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染.已知:
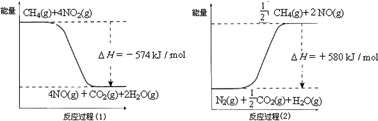
反应过程(2)是________反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是________.
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl4(g)+H2(g)⇌CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
实验
序号 | 温度℃ | 初始n(CCl4)
(mol) | 初始n(H2)
(mol) | 平衡时n(CHCl3)
(mol) |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
①此反应在110℃时平衡常数为________. ②实验l中,CCl4的转化率为________.
③判断该反应的正反应是________(填“放热”或“吸热”),理由是________.
④为提高实验3中CCl4的转化率,可采取的措施是________.
a.使用高效催化剂 b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H2.
-
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成
①写出 与
与 反应生成
反应生成 和
和 的热化学方程式 ______。
的热化学方程式 ______。
已知: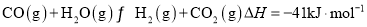 ,
,
 ,
,

②科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以 和
和 合成
合成

写出铜电极表面的电极反应式 ______ 。为提高该人工光合系统的工作效率,可向装置中加入少量 ______  选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸” 。
。
③另一生成 的途径是
的途径是 ,某温度下,将
,某温度下,将 和
和 充入10L的密闭容器内发生反应
充入10L的密闭容器内发生反应 ,平衡时
,平衡时 的转化率为
的转化率为 ,求此温度下该反应的平衡常数
,求此温度下该反应的平衡常数 ______
______  计算结果保留两位有效数字
计算结果保留两位有效数字 。
。
(2)天然气中的 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为 ,一定条件下向
,一定条件下向 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 ______。
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 ______。
(3)天然气的一个重要用途是制取 ,其原理为:
,其原理为: 。在密闭容器中通入物质的量浓度均为
。在密闭容器中通入物质的量浓度均为 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强 ______
______  (填“大于”或“小于”
(填“大于”或“小于” ;压强为
;压强为 时,在y点:v(正) ______ v(逆)(填“大于”、“小于”或“等于”)。
时,在y点:v(正) ______ v(逆)(填“大于”、“小于”或“等于”)。

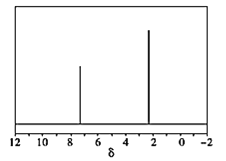
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃 由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图,则X的结构简式为 ______。
由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图,则X的结构简式为 ______。
-
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式
已知: CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中
通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
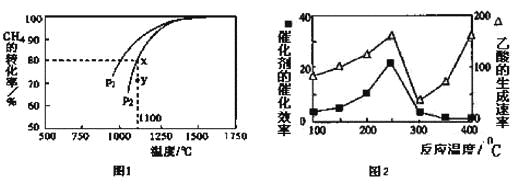
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
(4) 以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
-
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式____________
已知: CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中
通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式____________。
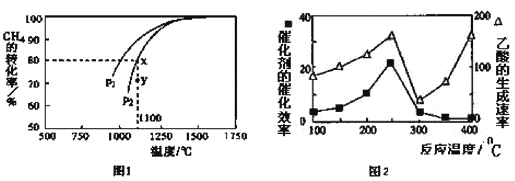
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K=__________。(计算结果保留两位有效数字)
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K=__________。(计算结果保留两位有效数字)
(4)以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________。
②为了提高该反应中CH4的转化率,可以采取的措施是________________。
-
甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
Ⅰ.煤制天然气时会发生多个反应,生产过程中有多种途径生产CH4。
已知:
① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
写出CO2与H2反应生成CH4和H2O的热化学方程式____________________ 。
Ⅱ.新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液(滴有几滴酚酞)电解实验,如图所示:
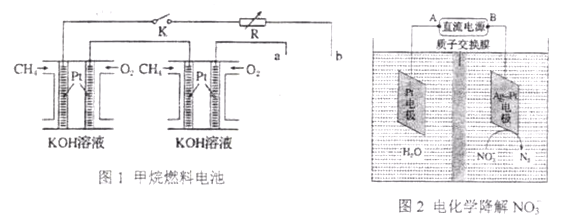
回答下列问题:
(1)①用甲烷燃料电池作为电化学降解NO3-装置的直流电源时,应将A与_____相连(填a或b,下同)B与_____相连。阴极反应式为_____________。
②若电解过程中转移了2mol电子,则膜的两侧电解液的质量变化差( Δm左- Δm右)为________g。
(2)甲烷燃料电池正极、负极的电极反应分别为________ 、_________。
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则图二电解池中理论上Pt最多能产生的氯气体积为________L(标准状况)。
-
茶叶中含有咖啡因和单宁等多种物质。咖啡因有弱碱性,又叫咖啡碱;单宁有弱酸性,又叫单宁酸。咖啡因既是天然的食品添加剂,又是制药工业的重要原料,从茶叶中提取咖啡因具有重要的意义。咖啡因的溶解性状况如下表。
| 溶剂 | 沸水(100 ℃) | 热水(80 ℃) | 水(25 ℃) | 热乙醇(60 ℃) | 乙醇(25 ℃) | 氯仿(25 ℃) | 乙醚(25 ℃) |
| 溶解度/g | 66.6 | 18.2 | 2 | 4.5 | 2 | 18.2 | 0.19 |
单宁酸能溶于水、乙醇、丙酮和甘油,几乎不溶于乙醚、苯、氯仿和石油醚。
(1)从茶叶中浸取咖啡因,下列溶剂中最好的是________(用字母符号填空),这样选择的理由是________________________________________________________________________
________________________________________________________________________。
A.热乙醇 B.沸水 C.乙醇与乙醚的混合物
(2)用所选择的溶剂浸取的咖啡因溶液里含有的主要杂质是________。
(3)从澄清的茶叶浸取液中提取不带结晶水的咖啡因或带结晶水的咖啡因,都需要有一个合理的实验方案和操作步骤。请从下列项目中选取,先组成提取不带结晶水的咖啡因的实验操作步骤,再组成提取带结晶水咖啡因的实验操作步骤:______________;______________。
①蒸发浓缩 ②焙炒 ③加石灰、蒸干 ④升华 ⑤过滤 ⑥冷却结晶
-
茶叶中含有咖啡因和单宁等多种物质。咖啡因有弱碱性,又叫咖啡碱;单宁有弱酸性,又叫单宁酸。咖啡因既是天然的食品添加剂,又是制药工业的重要原料,从茶叶中提取咖啡因具有重要的意义。咖啡因的溶解性状况如下表。
| 溶剂 | 沸水(100 ℃) | 热水(80 ℃) | 水(25 ℃) | 热乙醇(60 ℃) | 乙醇(25 ℃) | 氯仿(25 ℃) | 乙醚(25 ℃) |
| 溶解度/g | 66.6 | 18.2 | 2 | 4.5 | 2 | 18.2 | 0.19 |
单宁酸能溶于水、乙醇、丙酮和甘油,几乎不溶于乙醚、苯、氯仿和石油醚。
(1)从茶叶中浸取咖啡因,下列溶液中最好的是________(填字母代号),这样选择的理由是________________________________________________________________________
________________________________________________________________________。
A.热乙醇 B.沸水 C.乙醇与乙醚的混合物
(2)用所选择的溶剂浸取的咖啡因溶液里含有的主要杂质是__________。
(3)从澄清的茶叶浸取液中提取不带结晶水的咖啡因或带结晶水的咖啡因,都需要有一个合理的实验方案和操作步骤。请从下列项目中选取,先组成提取不带结晶水的咖啡因的实验操作步骤:______________,再组成提取带结晶水咖啡因的实验操作步骤:______________。(填序号)
①蒸发浓缩 ②焙烧 ③加石灰、蒸干 ④升华 ⑤过滤 ⑥冷却结晶


,可导致过程(二)中催化剂失效



 ,
,




