-
(17分)工业上用NH3和CO2反应合成尿素:
2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g) △H1 = -536.1 kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 = -536.1 kJ·mol-1
(1)此反应的平衡常数表达式K= 。升高温度,K值 (填增大、减小或不变)。
(2)其他条件不变,下列方法能同时提高化学反应速率和尿素产率的是 。
A.通入氦气 B.缩小体积
C.加入催化剂 D.除去体系中的水蒸气
(3)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。又知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 = -1806.4 kJ·mol-1,写出CO(NH2)2(g)与NO反应的热化学方程式 。
某小组模拟工业合成尿素,探究起始反应物的氨碳比[n(NH3)/n(CO2)]对尿素合成的影响。在恒温下1L容器中,将总物质的量为3mol的NH3和CO2以不同的氨碳比进行反应,实验测得平衡体系中各组分的变化如图所示。回答问题:
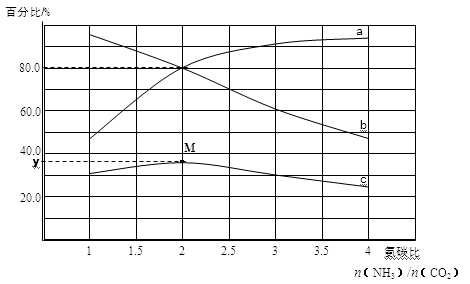
(4)若a、b线分别表示NH3或CO2转化率的变化,其中表示NH3转化率的是 (填a或b)线。
(5)若a、b线分别表示NH3或CO2转化率的变化,c线表示平衡体系中尿素体积分数的变化,求M点对应的y值(写出计算过程,结果精确到0.1)。
-
尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
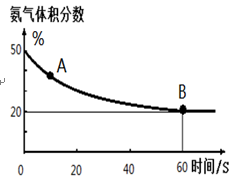
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为_________________。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:
2NH3(g)+CO2(g)  NH2COONH4(s)
NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①关于上述反应的焓变、熵变说法正确的是( )
A.∆H<0 ,∆S<0 B.∆H>0, ∆S<0 C.∆H>0, ∆S>0 D.∆H<0, ∆S>0
②关于上述反应的平衡状态下列说法正确的是________________。
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基
甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,
忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素。此时溶液中c(NH4+)= ;(填具体数值)NH4+水解平衡常数值为 。
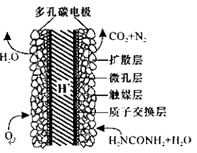
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,写出该电池的负极反应式: 。
-
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) ⇌ CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) ⇌ NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) ⇌ CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、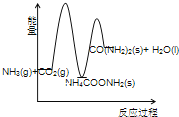 B、
B、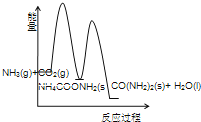
C、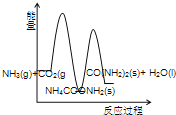 D、
D、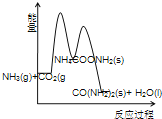
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
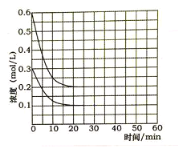
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
-
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) ⇌ CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) ⇌ NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) ⇌ CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、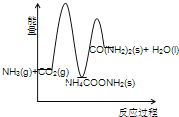 B、
B、
C、 D、
D、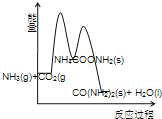
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
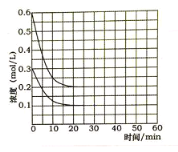
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
-
(14分)尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
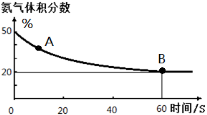
A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s)
NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①关于上述反应的焓变、熵变说法正确的是 。
A.∆H<0, ∆S<0 B.∆H>0, ∆S<0
C.∆H>0, ∆S>0 D.∆H<0, ∆S>0
②关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1 L0.1 mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052 mol氨基甲酸铵,此时溶液中几乎不含碳元素。此时溶液中c(NH4+ )= ;
NH4+ 水解平衡常数值为 。
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,写出该电池的负极反应式: 。
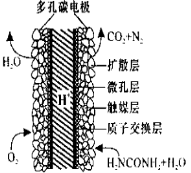
-
工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
(1)在密闭容器中充入NH3和CO2 ,一定条件能自发进行的原因是__________________
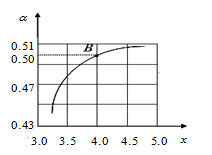
(2)T1℃ 时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是 ;
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是 ;
(3)当x=2,上述反应至5min时各物质的浓不再发生变化,若起始的压强为P0 KPa,测得平衡体系压强变为起始时的 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。
试计算该反应的平均速率v(CO2)= ,
该反应的平衡常数(K)=____ _,
达到平衡后NH3的物质的量浓度为 ,
-
CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g)  CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
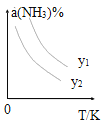
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH_____0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[ ],则y1________y2。(填“>”、“<”或“=”);
],则y1________y2。(填“>”、“<”或“=”);
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
①该反应逆反应速率表达式为:v逆=k•c(CO) •c3(H2),k 为速率常数,在某温度下测得实验数据如表:
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.05 | c1 | 4.8 |
| c2 | c1 | 19.2 |
| c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为____L3•mol-3•min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________;该温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
-
CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g)  CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
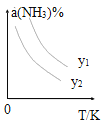
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH_____0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[ ],则y1________y2。(填“>”、“<”或“=”);
],则y1________y2。(填“>”、“<”或“=”);
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
①该反应逆反应速率表达式为:v逆=k•c(CO) •c3(H2),k 为速率常数,在某温度下测得实验数据如表:
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.05 | c1 | 4.8 |
| c2 | c1 | 19.2 |
| c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为____L3•mol-3•min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________;该温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
-
合成尿素的反应2NH3(g) + CO2(g)→CO(NH2)2(s)(尿素) + H2O(l) + Q分两步进行:
①2NH3(g) + CO2(g)→NH4COONH2(s) + Q1,
②NH4COONH2(s)→CO(NH2)2(s) + H2O(l)–Q2。
下列示意图中,能正确表示合成尿素过程中能量变化的是

-
工业上常利用CO2为初始反应物,合成一系列重要的化工原料。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)=NH2COONH4(s)ΔH1
反应Ⅱ:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
请回答下列问题:
①反应Ⅰ的ΔH1=______________。
②在________(填“高温”或“低温”)情况下有利于反应Ⅱ的自发进行。
③一定温度下,在体积固定的密闭容器中按n(NH3)∶n(CO2)=2∶1 进行反应Ⅰ。下列能说明反应Ⅰ达到了平衡状态的是____________(填字母代号)。
A 混合气体的平均相对分子质量不再变化
B 容器内气体总压强不再变化
C NH3与CO2的转化率相等
D 容器内混合气体的密度不再变化
(2)将CO2和H2按质量比25∶3充入一定体积的密闭容器中,在不同温度下发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CH3OH(g)的物质的量随时间的变化如下图所示。

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K(Ⅰ)______(填“>”“<”或“=”)K(Ⅱ)。
②欲提高CH3OH(g)的平衡产率,可采取的措施除改变温度外,还有__________(任写两种)。
③一定温度下,在容积均为2 L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡。
| 容器 | 甲 | 乙 |
| 反应物起 始投入量 | 1 mol CO2、 3 mol H2 | a mol CO2 b mol H2 c mol CH3OH(g) c mol H2O(g) (a,b,c均不为0) |
若甲容器中反应达平衡后气体的压强为开始时的 ,则该温度下,反应的平衡常数为______;要使反应达平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_______________。
,则该温度下,反应的平衡常数为______;要使反应达平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_______________。
CO(NH2)2(g)+ H2O(g) △H1 = -536.1 kJ·mol-1



 B、
B、
 D、
D、

 B、
B、
 D、
D、







