-
磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1) 已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
| 物质 | H3PO4 | HF |
| 电离常数 | Ka1=7.1×10-3,Ka2=6.3×10-8, Ka1=4.2×10-13 | Ka=6.6×10-4 |
向 NaF 溶液中滴加少量 H3PO4溶液,反应的离子方程式为_____________。
(2) 已知:
Ⅰ.CaO(s)+H2SO4(l)  CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1
CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)  Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ·mol-1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ·mol-1
则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为_____________。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率_______(填“ 增大”“ 减小”或“ 不变”,下同); HF的平衡浓度__________。
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物 CO 可用于制备 H2,原理为
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH。
CO2(g)+H2(g) ΔH。
①一定温度下,向 10 L 密闭容器中充入0.5 mol CO和 1 mol H2O(g),2 min 达到平衡时,测得 0~2 min 内用 CO2 表示的反应速率 v(CO2)=0.02 mol·L-1·min-1。则 CO的平衡转化率 α=________;该反应的平衡常数 K=______________。
②在压强不变的密闭容器中发生上述反应,设起始的 ,CO 的平衡体积分数(φ)与温度(T) 的关系如图所示。
,CO 的平衡体积分数(φ)与温度(T) 的关系如图所示。
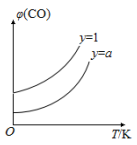
则:该反应的 ΔH________0(填“>” “ <” 或“=”,下同)。 a______1,理由为_______________。
-
磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
| 物质 | H3PO4 | HF |
| 电离常数 | Ka1=7.1×10-3;Ka2=6.3×10-8;Ka3=4.2×10-13 | Ka=6.6×10-4 |
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为___。
(2)已知:Ⅰ.CaO(s)+H2SO4(l)⇌CaSO4(s)+H2O(l) ΔH=-271kJ•mol-1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)⇌Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ•mol-1
则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为___。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率___(填“增大”“减小”或“不变”,下同);HF的平衡浓度___。
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH。
①一定温度下,向10L密闭容器中充入0.5molCO和1molH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol•L-1•min-1。则CO的平衡转化率α=___;该反应的平衡常数K=___。
②在压强不变的密闭容器中发生上述反应,设起始的( )=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a___1,理由为___。
)=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a___1,理由为___。
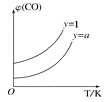
-
磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25°C时,磷酸和碳酸的电离常数如下表所示。

向Na2CO3溶液中滴加少量H3PO4溶液,反应的离子方程式为__。
(2)已知:
I.CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ∆H= -271kJ·mol-1
II.5CaO(s)+3H3PO4(l)+HF(g)=Ca3(PO4)3F(s)+5H2O(l) ∆H=-937 kJ·mol-1
回答下列问题:
①工业上用Ca3(PO4)3F和硫酸反应制备磷酸的热化学方程式为__。
②一定条件下,在密闭容器中只发生反应II,达到平衡后缩小容器容积,HF的平衡转化率__(填“增大”“减小”或“不变”,下同);HF的平衡浓度__。
(3)工业上用磷尾矿制备Ca3(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)=CO2(g)+H2(g) ∆H。
①一定温度下,向10L密闭容器中充入0.5molCO和lmolH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L-1·min-1。则CO的平衡转化率a=__,该反应的平衡常数K=__。
②在压强不变的密闭容器中发生上述反应,设起始的 =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的∆H__0(填“>”“<”或“=”,下同)。a_1,理由为__。
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的∆H__0(填“>”“<”或“=”,下同)。a_1,理由为__。

-
25℃时,三种酸的电离平衡常数如下表所示。
回答下列问题:
(1)pH相等的 溶液、
溶液、 溶液、
溶液、 溶液中,物质的量浓度最小的是____________(填化学式)。
溶液中,物质的量浓度最小的是____________(填化学式)。
(2)已知 为正盐,依据表格数据,
为正盐,依据表格数据, 的第二级电离平衡常数表达式
的第二级电离平衡常数表达式 ___________;25℃时,5.6mol·L-1
___________;25℃时,5.6mol·L-1 溶液的pH=____________。
溶液的pH=____________。
(3)向体积均为10mL、 均为
均为 mol·L-1的
mol·L-1的 溶液和一元酸
溶液和一元酸 溶液中,分别加水稀释至1000mL,稀释过程中
溶液中,分别加水稀释至1000mL,稀释过程中 的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)
的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”) 的电离平衡常数,理由是______________________________。
的电离平衡常数,理由是______________________________。
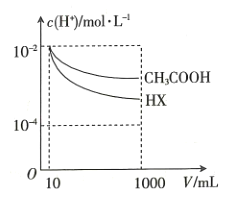
(4)常温下,将0.05mol·L-1的氨水逐滴加入10mL0.1mol·L-1 溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
-
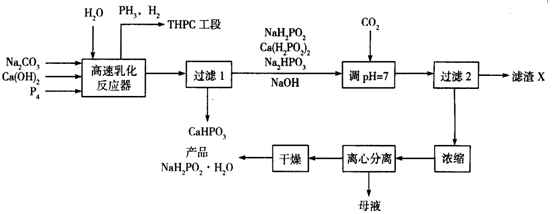
化学镀镍是指不使用外加电流,利用氧化还原作用在金属制件的表面上沉积一层镍的方法。次磷酸钠(NaH2PO2)是化学镀镍的重要原料,工业上制备NaH2PO2·H2O的流程如下:
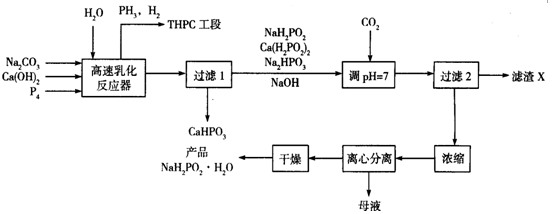
回答下列问题:
⑴次磷酸钠(NaH2PO2)是次磷酸(H3PO2)与足量NaOH溶液反应的产物,NaH2PO2属于_______(填“正盐”“酸式盐”“碱式盐”), NaH2PO2中磷元素的化合价为___________。
(2)在反应器中加入乳化剂并高速搅拌的目的是________________
(3)在反应器中发生多个反应,其中白磷(P4)与Ca(OH)2反应生成次磷酸钠及磷化氢的化学方程式为_________________________
(4)流程中通入CO2的目的是______________,滤渣X的化学式为_____________
(5)流程中母液中的溶质除NaH2PO2外,还有的一种主要成分为_____________
(6)含PH3的废气可用NaClO和NaOH的混合溶液处理将其转化为磷酸盐,该反应的离子方程式为____________
(7)某次生产投入的原料白磷为1240 kg,在高速乳化反应器中有80%的白磷转化为次磷酸钠及磷化氢,忽略其它步骤的损失,理论上最终得到产品NaH2PO2·H2O的质量应为__________kg(NaH2PO2·H2O的相对分子质量为106)
-
化学镀镍是指不使用外加电流,利用氧化还原作用在金属制件的表面上沉积一层镍的方法。次磷酸钠(NaH2PO2)是化学镀镍的重要原料,工业上制备NaH2PO2·H2O的流程如下:
回答下列问题:
⑴次磷酸钠(NaH2PO2)是次磷酸(H3PO2)与足量NaOH溶液反应的产物,NaH2PO2属于_______(填“正盐”“酸式盐”“碱式盐”), NaH2PO2中磷元素的化合价为___________。
(2)在反应器中加入乳化剂并高速搅拌的目的是________________
(3)在反应器中发生多个反应,其中白磷(P4)与Ca(OH)2反应生成次磷酸钠及磷化氢的化学方程式为_________________________
(4)流程中通入CO2的目的是______________,滤渣X的化学式为_____________
(5)流程中母液中的溶质除NaH2PO2外,还有的一种主要成分为_____________
(6)含PH3的废气可用NaClO和NaOH的混合溶液处理将其转化为磷酸盐,该反应的离子方程式为____________
(7)某次生产投入的原料白磷为1240 kg,在高速乳化反应器中有80%的白磷转化为次磷酸钠及磷化氢,忽略其它步骤的损失,理论上最终得到产品NaH2PO2·H2O的质量应为__________kg(NaH2PO2·H2O的相对分子质量为106)
-
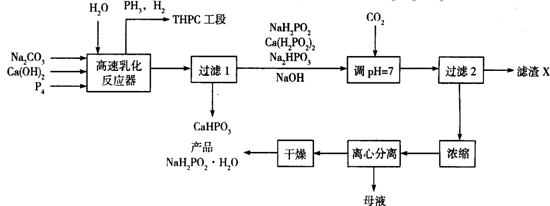
次磷酸钠(NaH2PO2)是化学镀镍的重要原料,工业上制备NaH2PO2·H2O的流程如下:
回答下列问题:
(1)NaH2PO2·H2O中磷元素的化合价为_________________。
(2)在反应器中加入乳化剂并高速搅拌的目的是______________________________。
(3)在反应器中发生多个反应,其中Ca(OH)2与P4反应生成次磷酸钙及磷化氢的化学方程式为________________________________________________________________。
(4)流程中通入CO2的目的是______________________________________________,滤渣X的化学式为______________________。
(5)流程中母液中的溶质除NaH2PO2外,还有的一种主要成分为___________________。
(6)含磷化氢的尾气可合成阻燃剂THPC{[P(CH2OH)4]Cl}。含PH3的废气可用NaClO和NaOH的混合溶液处理将其转化为磷酸盐,该反应的离子方程式为__________。
-
高分子材料G在工业上有重要用途。G可由某石油化工产品R为原料合成,其流程如下:
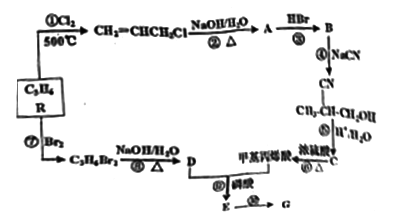
已知以下信息:
I.磷酸的结构式为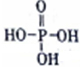
Ⅱ.G的结构简式为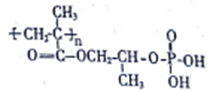
回答下列问题:
(1)A分子中官能团名称是_____________、D的名称是____________。
(2)①、⑩的反应类型是____________、____________。
(3)lmolE与足量的NaOH溶液反应时,消耗NaOH物质的量是_______mol。
(4)满足下列条件的C的同分异构体共有__________种。
a.能发生银镜反应 b.能与Na反应产生氢气 c.能发生水解反应
(5)写出④步反应的方程式________________________________。
(6)磷的化合物三氯氰磷(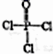 )与季戊四醇(
)与季戊四醇(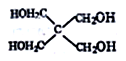 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。X的核磁共振氢谱如右图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。X的核磁共振氢谱如右图所示。
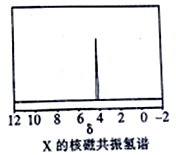
①酸性气体是___________________(填化学式)
②X的结构简式是_____________________________________。
-
(15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式__________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量_____;充入氦气,混合气体的密度____(选填“增大”、“减小”、“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 ;
将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 ;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原的千分之一)则应向溶液里加NaOH溶液,使溶液pH为 。
-
【化学—选修2:化学与技术】(15分)化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。氮的化合物是重要的化工原料,在工农业生产中有很多重要应用。工业上合成氨的流程示意图如下:
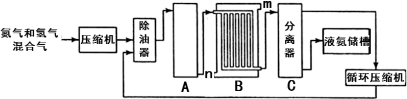
回答下列问题:
(1)25℃时合成氨反应热化学方程式为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ/mol。在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是___________________________________________________________。
2NH3(g) ΔH=-92.4kJ/mol。在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是___________________________________________________________。
(2)原料氢气的来源是水和碳氢化合物,写出工业生产中分别采用煤和天然气为原料制取氢气的化学反应方程式:___________________________, 。
(3)设备B的名称________________,其中m和n是两个通水口,入水口是 (填“m”或“n”),不宜从相反方向通水的原因_________________________________。
(4)设备C的作用是____________________________________________________。
(5)为了提高其产量,降低能耗,近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是_________________________________________________________________________________;
与传统的合成氨的方法比较,该方法的优点是________________________________________。
CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ·mol-1
CO2(g)+H2(g) ΔH。
,CO 的平衡体积分数(φ)与温度(T) 的关系如图所示。









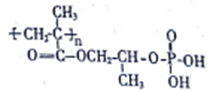
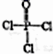 )与季戊四醇(
)与季戊四醇( )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。X的核磁共振氢谱如右图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。X的核磁共振氢谱如右图所示。
