-
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?________________________________________________________。
(2)在400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:__________________________________________。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?________(填“是”或“否”),是否可以增大该反应放出的热量?________(填“是”或“否”)。
(4)为提高SO3吸收率,实际生产中用________吸收SO2。
(5)已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.9 kJ·mol-1,计算每生产1万吨98%的硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g)+ O2(g)
O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K= ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________ v(逆)(填“<”、“>”或“=”)。
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________ v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以如图所示装置,用电化学原理生产硫酸, 写出通入O2电极的电极反应式为________。
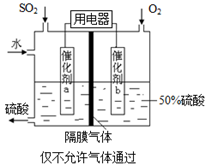
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为_____。
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2+ O2⇌SO3△H=-98KJ•mol-1
O2⇌SO3△H=-98KJ•mol-1
(1)在T1温度时,该反应的平衡常数 ,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2、16.0molO2和3.0molSO3,则反应开始时正反应速率______逆反应速率(填“<”、“>”或“=”).
,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2、16.0molO2和3.0molSO3,则反应开始时正反应速率______逆反应速率(填“<”、“>”或“=”).
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ.此时二氧化硫的转化率为______.
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是______(填字母).
A.保持温度和容器体积不变,充入1.0molO2
B.保持温度和容器内压强不变,充入2.0molSO2和5.0molO2
C.降低温度
D.在其他条件不变时,减小容器的容积
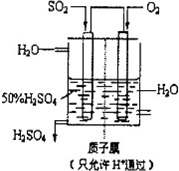
(4)有人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______.
(5)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时, =______.[已知该温度时,
=______.[已知该温度时, ,
, ].
].
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤,已知
SO2(g)+ O2(g)
O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K= ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v正________________________________ ________________________________v逆(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________________________ ________________________________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________________ ________________________(填字母)。
A保持温度和容器体积 不变,充入1.0 mol O2
不变,充入1.0 mol O2
B保持温度和容器内压强不变,充入1.0 mol SO3
C降低 温度
温度
D移动活塞压缩气体
(4)若以右图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为________________________ ________________________________________________。

(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为________________________________________________________ 。
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:SO2(g)+
 O2(g)⇌SO3(g)+98kJ
O2(g)⇌SO3(g)+98kJ
(1)某温度下该反应的平衡常数K= ,若在此温度下,向100L的恒容密闭容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),则反应开始时v(正)______v(逆)(填“<”、“>”或“=”).
,若在此温度下,向100L的恒容密闭容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),则反应开始时v(正)______v(逆)(填“<”、“>”或“=”).
(2)一定温度下,向一带活塞的体积为20L的密闭容器中充入0.4mol SO2和0.2mol O2,达到平衡后体积变为16L,则平衡后SO2转化的百分率为______.
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是______(填字母).
A.保持温度和容器体积不变,充入0.2mol O2
B.保持温度和容器内压强不变,充入0.4mol SO3
C.降低温度
D.移动活塞压缩气体
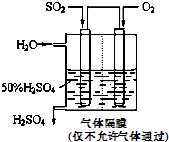
(4)若以图所示装置,用电化学原理生产硫酸,为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为______.
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+ O2(g) 2SO3(g);△H= mkJ·mol-1
2SO3(g);△H= mkJ·mol-1
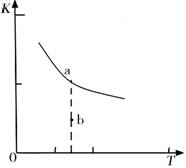
K的大小与温度(T)的关系如右图中曲线所示,则m________0(填“>”“=”或“<”);
b点时v(正) ________v(逆)(填“<”、“>”或“=”)。反应的焓变(△H)将________(填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。
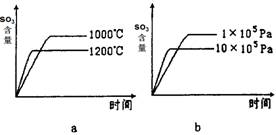
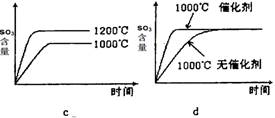
(3)某硫酸厂利用S02尾气、废铁屑、空气、水合成绿矾(FeS04·7H20),反应中作还原剂的物质是________ 。
(4)将反应后的混合气体用氨水吸收可得到 (NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是________
②在(NH4)2SO4溶液中存在:NH4++H2O NH3·H2O+H+,则该反应常温下的平衡常数K=________(已知:常温下,
NH3·H2O+H+,则该反应常温下的平衡常数K=________(已知:常温下, 的电离平衡常数Kb=1.7×10—5 mol·L—1)
的电离平衡常数Kb=1.7×10—5 mol·L—1)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)________。万一误服了少量BaCO3,应尽快用大量0.5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol/L(己知25℃时,Ksp(BaSO4)=l×10-10,Ksp(BaCO3)=1×l0-9)。
-
(17分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+O2(g) 2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正)________v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将________(填“增大”、“减小”或“不变”)。
2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正)________v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将________(填“增大”、“减小”或“不变”)。

(2)若反应物起始的物质的量相同,下列关系图不正确的是________(填序号)。

(3)某硫酸厂利用SO2尾气、废铁屑、空气、水合成绿矾(FeS04·7H2O),反应中作还原剂的物质是________。
(4)将反应后的混合气体用氨水吸收可得到(NH4)2SO3和(NH4)2SO4两种化工原料。
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO2-3)十c(HSO-3)+c(H2SO3)]=c(NH+4)+c(NH3·H2O)
请分析该同学的依据是________。
②在(NH4)2 SO4溶液中存在:NH+4+ H2O NH3·H2O+H+,则该反应常温下的平衡常数K=________(已知:常温下,NH3·H2O的电离平衡常数K=1. 7×10-5)
NH3·H2O+H+,则该反应常温下的平衡常数K=________(已知:常温下,NH3·H2O的电离平衡常数K=1. 7×10-5)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)________。万一误服了少量BaCO4,应尽快用大量0. 5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为mol/L(已知25℃时,Ksp(BaSO4)=1×l0-10 ,Ksp(BaCO3)=1×10-9).
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: §SO2(g) +1/2O2(g) SO3(g)+ 98 kJ
SO3(g)+ 98 kJ
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)
________v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为20 L的密闭容器中充入0.4 mol SO2和0.2 mol O2,达到平衡后体积变为16 L,则平衡后SO2转化的百分率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入0.2 mol O2
B.保持温度和容器内压强不变,充入0.4 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以下图所示装置,用电化学原理生产硫酸, 为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________。

-
(10分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:
SO2(g) +1/2O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的
是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为________;
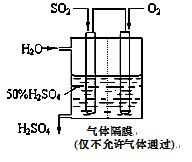
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________________。
-
(10分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:
SO2(g) +1/2O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的
是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为________;
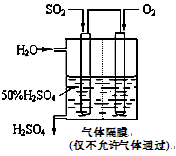
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________________。
2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正)________v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将________(填“增大”、“减小”或“不变”)。


NH3·H2O+H+,则该反应常温下的平衡常数K=________(已知:常温下,NH3·H2O的电离平衡常数K=1. 7×10-5)









