-
工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1。
CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
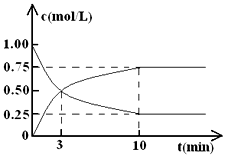
(1)从反应开始到平衡,氢气的平均反应速率v( H2 )= ________ ,CO2的转化率=________。
(2)该反应的平衡常数表达式k= __________ 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是_________________ (填编号)。
A.将H2O(g)从体系中分离 B.充入He(g),使体系压强增大
C.升高温度 D.再充入lmolCO2和3molH2
-
(11分) (1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
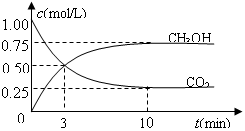
①从反应开始到平衡,平均反应速率v(CO2)=________mol/(L·min)。
②该反应的平衡常数表达式为________________________________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2 ,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由: , 。
-
降低大气中 CO2 的含量及有效地开发利用 CO2,已受到各国的普遍重视。目前工业上有一种方法是用 CO2 来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为 1L 的恒容密闭容器中,充入 1mol CO2 和 3mol H2,一定条件下发生反应: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2 和 CH3OH(g)的浓度随时间变化如下图所示。
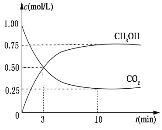
(1)在恒温恒容条件下,下列能说明反应达到化学平衡状态的是 _________(选填字母)
A.体系压强不再改变 B.气体密度不再改变 C.CO2 的浓度不再改变 D.v 正(CO2)= v 逆(H2)
(2) 从反应开始到平衡,氢气的平均反应速率 v(H2)=________mol/(L·min)。
(3)在该温度下,该反应的平衡常数为_________(保留小数点后 2 位)。
(4)下列措施中能使平衡体系中 n(CH3OH)/n(CO2)增大的是_________(选填字母)。
A.升高温度 B.充入 He(g),使体系压强增大 C.将 H2O(g)从体系中分离出去 D.再充入 1mol H2
(5)当反应达到平衡时,H2 的物质的量浓度为 c1,然后向容器中再加入一定量 H2,待反应再一次达到平衡后,H2 的物质的量浓度为 c2,则 c1________________c2(填“>”、“<”或“=”)。
-
工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从反应开始到平衡,氢气的平均反应速率v(CO2)= ________mol/(L•min);
(2)氢气的转化率= ________;
(3)求此温度下该反应的平衡常数K=________;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1mol CO2和3mol H2
(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,待反应再一次达到平衡后,CO2的物质的量浓度为c2,则c1________ c2(填>、<、=)
-
工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从反应开始到平衡,氢气的平均反应速率v(CO2)= ________mol/(L•min);
(2)氢气的转化率= ________;
(3)求此温度下该反应的平衡常数K=________;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________
A.将H2O(g)从体系中分离出去
B.充入He(g),使体系压强增大
C.升高温度
D.再充入1mol CO2和3mol H2
(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,待反应再一次达到平衡后,CO2的物质的量浓度为c2,则c1________ c2(填>、<、=)
-
用CO2来生产燃料甲醇是工业上一种有效开发利用CO2的方法。为探究反应原理,进行如下实验,在体积为1 L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
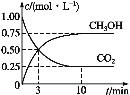
(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=__mol·L-1·min-1。
(2)氢气的转化率=__。
(3)求此温度下该反应的平衡常数K=__。
(4)下列措施中能使平衡体系中 增大的是__。
增大的是__。
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1mol H2
(5)当反应进行到3min末时,下列说法正确的是___(填字母)。
A.CO和CH3OH(g)的物质的量浓度相等
B.用CO和CH3OH(g)表示的化学反应速率相等
C.上述反应达到平衡状态
D.3 min后该反应的正反应速率逐渐增大
(6)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,待反应再一次达到平衡后,CO2的物质的量浓度为c2,则c1___c2(填“>”“<”或“=”)。
-
Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视.
(1)工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g).实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示.
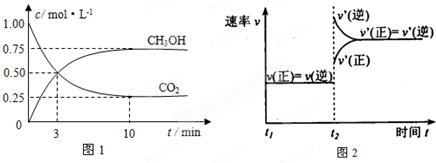
①从反应开始到平衡,氢气的平均反应速率v(H2)=______;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是______热(填“吸”或“放”)反应.
③该反应的平衡常数K为______(保留两位小数).若提高温度到800℃进行,达平衡时,K值______(填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为______.
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为______.
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
①2H2 (g)+CO(g)⇌CH3OH (g)△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2 (g)+H2(g)△H=-41.3kJ•mol-1
(3)总合成反应的热化学方程式为______.
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是______(填字母代号).
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(5)已知反应②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol•L-1 | 0.44 | 0.60 | 0.60 |
此时,v (正)______ v (逆) (填“>”、“<”或“=”).
-
(16分)Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
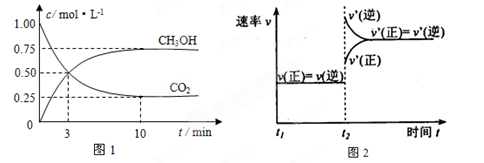
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________________;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
________热(填“吸”或“放”)反应。
③该反应的平衡常数K为________(保留两位小数)。若提高温度到800℃进行,达平衡时,K值________(填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为________。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为________________。
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(3)总合成反应的热化学方程式为___________ 。
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(5)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.44 | 0.60 | 0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。
-
(16分)Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
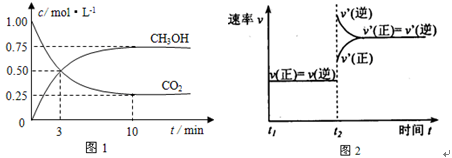
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________________;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
________热(填“吸”或“放”)反应。
③该反应的平衡常数K为________(保留两位小数)。若提高温度到800℃进行,达平衡时,K值________(填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为________。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为________________。
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
② 2H2 (g)+CO(g)  CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(3)总合成反应的热化学方程式为___________ 。
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(5)已知反应②2CH3OH(g)  CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.44 | 0.60 | 0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。
-
(8分)过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在1 L固定体积的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH>0,
CH3OH(g)+H2O(g) ΔH>0,
经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
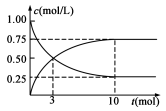
(1)从反应开始到平衡,CO2的平均反应速率v(CO2)= ;
(2)该反应的平衡常数表达式K = ;
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)
a.容器中压强不变 b.v正(H2)=v逆(H2O)
c.混合气体中c(H2O)不变 d.c(CO2)=c(CH3OH)
(4)下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
a.升高温度 b.将CH3OH(g)及时液化抽出
c.选择高效催化剂 d.再充入H2O(g)
CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1。









