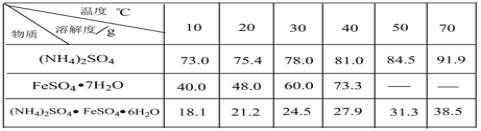-
(14分,每空2分) 硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)=FeSO4+H2↑、FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、洗涤、干燥、称量,铁屑质量为 1。
1。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是 (填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3· H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。
-
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:

(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是_________;
(2)浓度均为0.10mol•L-1的莫尔盐溶液和FeSO4溶液,c(Fe2+)前者______后者.(填“大于”、“小于”或“等于”或“无法判断”)
(3)0.10mol•L-1莫尔盐溶液中离子浓度由大到小的顺序为_________;
(4)常温下,若0.10mol•L-1(NH4)2SO4溶液的pH=5,求算NH3•H2O的电离平衡常数Kb≈________;
-
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4﹒7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:

(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是________。
(2)0.10mol·L-1莫尔盐溶液中离子浓度由大到小的顺序为_________;
(3)常温下,若0.1 mol﹒L-1 (NH4)2SO4溶液的pH=5,求算NH3﹒H2O的电离平衡常数Kb=___________
(4)为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为c mol﹒L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数. | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | .25.52, | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为:_______________。滴定终点的现象是____________________。
通过实验数据计算的该产品纯度为_________(用字母ac表)。上表中第一次实验中记录数据明显大于后两次,其原因可能是____________(填符号)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
-
硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]又称摩尔盐,难溶于乙醇,常用于定量分析。某实验小组利用工业废铁屑制取摩尔盐,并测定其纯度,工艺流程图如下。
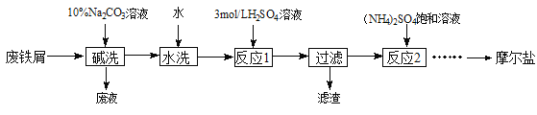
已知:硫酸铵、FeSO4·7H2O、硫酸亚铁铵在水中的溶解度
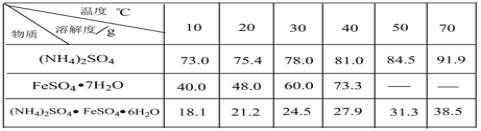
(1)碱洗的目的是_________。
(2)反应1温度需控制在70~75℃,可采取的措施是________。
(3)反应2中常用3 mol·L-1的硫酸调节溶液的pH为1~2,其目的是_______。
(4)请补充完整由反应2所得溶液获得硫酸亚铁铵晶体的实验方案:____、过滤、用乙醇洗涤、低温干燥。
(5)为测定硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O晶体纯度,做了如下实验:
准确称取0.4000g上述硫酸亚铁铵晶体置于锥形瓶中溶解,加适量稀硫酸酸化,用0.0100 mol·L-1 标准KMnO4溶液滴定,当MnO 恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00 mL。
恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为20.00 mL。
请回答下列问题:
①滴定终点的现象为____________。
②上述样品中(NH4)2SO4·FeSO4·6H2O晶体(相对分子质量为392)的质量分数为______。
③在上述方案的基础上,下列措施能进一步提高测定准确度的有_____(填字母)。
A.适当增加称量样品的质量 B.用盐酸替代H2SO4溶液
C.用酚酞做指示剂 D.多次实验,取平均值
-
(12分)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有__________(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中趁热过滤,其原因是________________________________;
(3)在步骤3制的的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+的试剂可以用K4〔Fe(CN)6〕生成普鲁士蓝沉淀,有关的离子方程式是_________________________ _____。
(4)制得的晶体经过过滤后用无水乙醇洗涤而不用蒸馏水,理由是__________________;(任说两点)
(5)在25℃时,相同物质的量浓度的(NH4)2CO3、(NH4)2SO4、硫酸亚铁铵三种盐溶液a、b、c,其铵根离子浓度由小到大的排列顺序为_______________(用a、b、c回答)
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1:将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2:向处理过的铁屑中加入过量的3 mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有________(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研体 ⑥玻璃棒 ⑦酒精灯
(2)在步骤1中用碳酸钠溶液除去油污的化学原理是________
(3)在步骤2中所加的硫酸必须过量,其原因是__________________________________
(4)在步骤3中,“一系列操作”依次为________、________ 和过滤;
(5)本实验制备的硫酸亚铁铵晶体常含有杂质Fe3+。检验Fe3+常用的试剂是________________,可以观察到得现象是_____________________________
-
以活性炭为催化剂,可以将工业废气中的SO2催化氧化变为硫酸,进而制得各种硫酸盐,如硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]等。
(1)研究表明,SO2在活性炭上催化氧化的反应机理可以表示为(*标记的为吸附状态)
Ⅰ.二氧化硫的吸附:SO2(g) SO2* ΔH1=a kJ·mol-1
SO2* ΔH1=a kJ·mol-1
Ⅱ.氧气的吸附:O2(g) 2O* ΔH2=b kJ·mol-1
2O* ΔH2=b kJ·mol-1
Ⅲ.三氧化硫的氧化:SO2*+O*=SO3* ΔH3=c kJ·mol-1
Ⅳ.三氧化硫的脱附:SO3* SO3(g) ΔH4=d kJ·mol-1
SO3(g) ΔH4=d kJ·mol-1
根据上述反应机理,写出SO2在活性炭上催化氧化的热化学方程式____。
(2)以硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为原料通过下列流程可以制备晶体A。
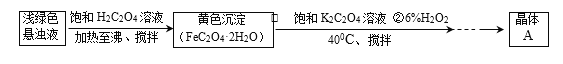
①已知25 ℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq) [Fe(SCN)]2+(aq)+3C2O42-(aq),K=10-16。某研究小组同学欲检验晶体A中含有三价铁,取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1 mol·L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:____。
[Fe(SCN)]2+(aq)+3C2O42-(aq),K=10-16。某研究小组同学欲检验晶体A中含有三价铁,取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1 mol·L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:____。
②某研究小组通过如下实验步骤测定晶体A的化学式:
步骤1:准确称取A样品4.910 0 g,干燥脱水至恒重,残留物质量为4.370 0 g;
步骤2:准确称取A样品4.910 0 g置于锥形瓶中,加入足量的3.000 mol·L-1 H2SO4溶液和适量蒸馏水,用0.500 0 mol·L-1 KMnO4溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为24.00 mL;(C2O42-+MnO4-+H+→CO2↑+Mn2++H2O)
步骤3:将步骤1所得固体溶于水,加入铁粉0.280 0 g,恰好完全反应。
通过计算确定晶体A的化学式(写出计算过程)。_____________
-
(13分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用下图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:

(1) 用30%的NaOH溶液和废铁屑(含少量油污、铁锈等)混合、煮沸,以除去铁屑表面油污,然后冷却、洗涤、分离,将分离出的NaOH溶液装入③中,废铁屑放入②中。
(2) 利用容器②的反应,向容器①中通入氢气,应关闭活塞________,打开活塞________(填字母)。向容器①中通人氢气的目的是________。
待锥形瓶中的铁屑快反应完时,关闭活塞________,打开活塞________②中继续产生的氢气会将________(填①、②或③,后同)容器中的溶液压入① ________ 容器,在常温下放置一段时间,混合溶液底部将结晶析出硫酸亚铁铵。
(3) 为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。
①试配平反应的离子方程式:

②滴定时,将KMnO4溶液装在________(酸式或碱式)滴定管中,判断反应到达滴定终点的现象为。
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”)________。
(5)观察装KMnO4滴定管读数时,若滴定前仰视,滴定后俯视则结果会导致测得的Fe2+溶液浓度测定值________(选填“偏大”“偏小”或“无影响”)
-
硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500 ℃时隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和SO2。
(1)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
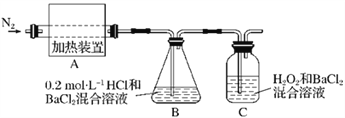
①A中固体充分加热较长时间后,通入氮气,目的是__________________________。
②为验证A中残留物是否含有FeO,需要选用的试剂有____________(填字母)。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有________气体生成,若含有该气体,观察到的现象为_______________________________________。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b________________a(填“大于”“小于”或“等于”)。
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应的离子方程式为______________________
(2)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,实验测定其与16.00mL 0.1000 mol/L KMnO4溶液恰好完全反应。已知(NH4)2Fe(SO4)2·6H2O的摩尔质量是392g/mol,则产品中(NH4)2Fe(SO4)2·6H2O的质量分数为_______________。
-
硫酸亚铁铵晶体的化学式可表示为(NH4)xFey(SO4)z· nH2O。用FeSO4溶液与(NH4)2SO4饱和溶液混合可析出硫酸亚铁铵晶体,过滤后取滤液分别进行下列实验:⑴向滤液中,滴加氯水,再滴入KSCN溶液,溶液变红;⑵向滤液中滴加MgCl2溶液,无白色沉淀生成;⑶向滤液中滴加NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝。下列说法正确的是
A.化学式中x=y=z B.滤液中含Fe2+
C.滤液中不含SO42- D.滤液中含NH4+
1。
。
。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。