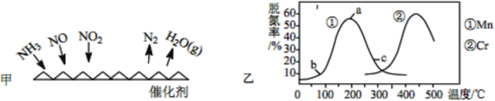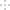-
运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g)  SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
NO2被吸收的离子方程式是 。
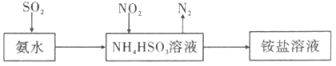
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
-
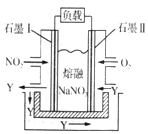
(14分)运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)某硝酸厂处理尾气中NO的方法是:催化剂存在时用H2将NO还原为N2。已知:
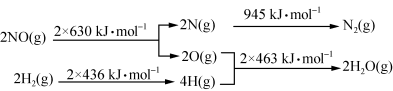
则氮气和水蒸气反应生成氢气和一氧化氮的热化学方程式是 。
(2)在压强为0.1 Mpa条件,将a mol CO和3a mol H2的混合气体在催化剂作用下转化为甲醇的反应如下:CO(g)+2H2(g) CH3OH(g) ΔH<0。
CH3OH(g) ΔH<0。
①该反应的平衡常数表达式为________________。
②若容器容积不变,下列措施可增大甲醇产率的是________。
A.升高温度
B.将CH3OH从体系中分离
C.充入He,使体系总压强增大
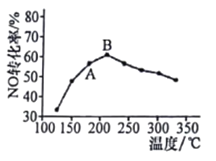
(3)某研究小组在实验室研究某催化剂效果时,测得NO转化为N2的转化率随温度变化情况如图。
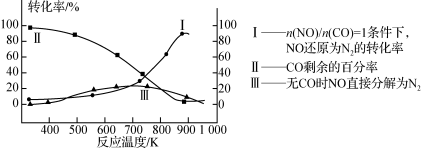
①若不使用CO,温度超过775 ℃,发现NO的分解率降低,其可能的原因为________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。
写出C2H6与NO2发生反应的化学方程式________________。
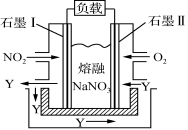
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为________________________。
-
运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO 还原NO 的脱硝反应:2CO(g)+2NO(g) ⇌2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) ⇌CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) ⇌2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g)⇌ 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,
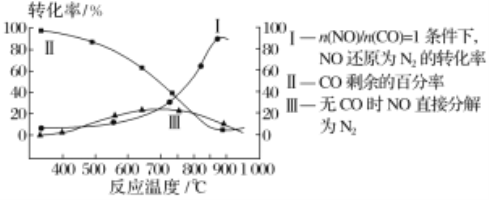
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为_________________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在____________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,写出C2H6与NO2发生反应的化学方程式:_________。
③NO2尾气常用NaOH溶液吸收,生成NaNO3和NaNO2。已知NO2-的水解常数K=2×10-11,常温下某NaNO2和HNO2混合溶液的pH为5,则混合溶液中c(NO2-)和c(HNO2)的比值为__________。
II.T ℃时,在刚性反应器中发生如下反应:CO(g)+NO2(g) ⇌CO2(g)+NO(g),化学反应速率v =k Pm(CO)Pn(NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:
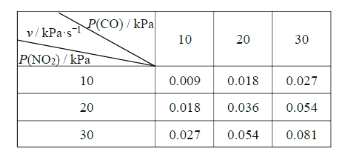
(3)若反应初始时P(CO)=P(NO2)=a kPa,反应t min时达到平衡,测得体系中P(NO)=b kPa,则此时v =___________ kPa·s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_____(Kp是以分压表示的平衡常数)。
-
运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO还原NO的脱硝反应:2CO(g)+2NO(g)⇌2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) ⇌CO2(g)+NO(g) △H1=-226kJ·mol-1
N2(g)+2O2(g)⇌2NO2(g) △H2=+68kJ·mol-1
N2(g)+O2(g)⇌2NO(g) △H3=+183kJ·mol-1
脱硝反应△H=___,有利于提高NO平衡转化率的条件是___(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如图所示。
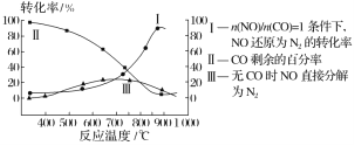
若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为____。
-
氮的化合物既是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。
(Ⅰ)消除氮氧化物有多种方法。
(1)NH3 催化还原法:原理如图所示
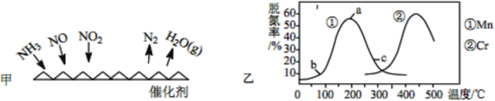
①若烟气中 c(NO2):c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为___________。
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_________;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是__________。
(2)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右下图所示。阳极的电极反应式为__________。

(Ⅱ)氨是重要的化工原料,工业合成氨有重要现实意义。
(1)在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
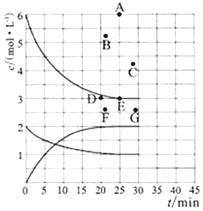
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00mol N2和12.00mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(2)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:2NO2(g)⇌N2O4(g) ∆H=-56.9kJ‧mol-1,测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____________。
②已知该反应v正(NO2)=k1‧c2(NO2),v逆(N2O4)=k2‧c(N2O4),其中k1、k2为速率常数,则373K时, =_________;改变温度至T1时,k1=k2,则T1_______373K(填“>”“<”或“=”)。
=_________;改变温度至T1时,k1=k2,则T1_______373K(填“>”“<”或“=”)。
-
消除含氮、硫等化合物的污染对建设美丽家乡,打造宜居环境具有重要意义。
I.用NH3催化还原NOx可以消除氮氧化物的污染,NOx若以NO为例,在恒容容器中进行反应:4NH3(g)+6NO(g)  5N2(g)+6H2O(g) ΔH<0。
5N2(g)+6H2O(g) ΔH<0。
(1)以下选项可以判断反应达到平衡状态的是_______。
A..4v正(NH3)=5v逆(N2) B.反应体系中气体密度不变
C..反应体系中气体压强不变 D.反应体系中气体平均摩尔质量不变
(2)图I中曲线表示转化率与反应时间的关系。若改变起始条件,使反应过程由a状态转为b状态进行,可采取的措施是_______
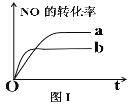
A.降低温度 B.增大反应物中NO的浓度
C.加催化剂 D.向密闭容器中通入氩气
II.燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化的碱吸收法同时脱除SO2和NO工艺,反应进程如图II所示。
反应1:NO(g)+O3(g) NO2(g)+O2(g)
NO2(g)+O2(g)
反应2:SO2(g)+O3(g) SO3(g)+O2(g)
SO3(g)+O2(g)
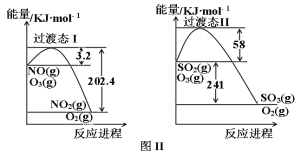
已知该体系中温度80℃以上臭氧发生分解反应:2O3 3O2。且100℃时臭氧的分解率约为10%。请回答:
3O2。且100℃时臭氧的分解率约为10%。请回答:
(1)写出反应1的热化学方程式_______,反应1在高温下不能自发进行,则该反应的熵变ΔS_______0(填“大于”或“小于”)。
(2)其他条件不变,向五个体积固定为1L的密闭容器中均充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0mol O3,在不同温度下反应相同时间后体系中NO和SO2的转化率如图所示:
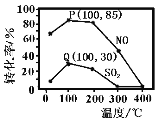
①若P、Q两点为非平衡点,试分析P点转化率大于Q点的可能原因_______。100℃,t秒时反应1进行到P点,反应从开始到t秒时NO的平均速率v(NO)=_______mol·L−1·s−1(用含t的式子表示)。
②若Q点为平衡点,100℃下反应2的平衡常数的数值约为_______(精确到0.01)。
-
利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
Ⅰ.脱硝:
(1)H2还原法消除氮氧化物
已知:N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)=H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8KJ·mol-1
在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为_____________。
(2)用NH3催化还原法消除氮氧化物,发生反应:
4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H<0
5N2(g)+6H2O(l) △H<0
相同条件下,在2L恒容密闭容器中,选用不同催化剂,产生N2的量随时间变化如图所示。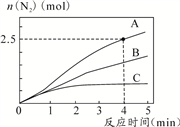
① 计算0~4分钟在A催化剂作用下,
反应速率v(NO)=_______。
② 下列说法正确的是________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已达到平衡
D.若反应在恒容绝热的密闭容器中进行,当K值不变时,说明已达到平衡
(3)微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
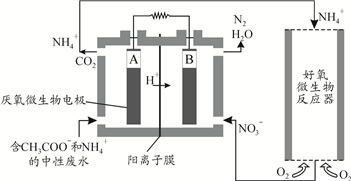
① 已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式_____________________。
② 解释去除NH4+的原理___________________。
Ⅱ.脱碳:
(4)用甲醇与CO反应生成醋酸可消除CO污染。常温下,将a mol·L-1醋酸与bmol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),忽略溶液体积变化,计算醋酸的电离常数Ka=__________(用含a、b的代数式表示)。
-
利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
Ⅰ.脱硝:
(1)H2还原法消除氮氧化物
已知:N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)=H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8KJ·mol-1
在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为_____________。
(2)用NH3催化还原法消除氮氧化物,发生反应:
4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H<0
5N2(g)+6H2O(l) △H<0
相同条件下,在2L恒容密闭容器中,选用不同催化剂,产生N2的量随时间变化如图所示。
① 计算0~4分钟在A催化剂作用下,
反应速率v(NO)=_______。
② 下列说法正确的是________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已达到平衡
D.若反应在恒容绝热的密闭容器中进行,当K值不变时,说明已达到平衡
(3)微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
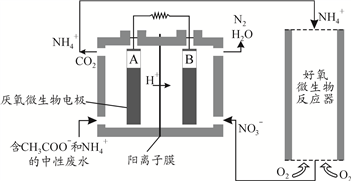
① 已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式_____________________。
② 解释去除NH4+的原理___________________。
Ⅱ.脱碳:
(4)用甲醇与CO反应生成醋酸可消除CO污染。常温下,将a mol·L-1醋酸与bmol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),忽略溶液体积变化,计算醋酸的电离常数Ka=__________(用含a、b的代数式表示)。
-
运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1) 用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的 活性炭和NO,发生 反应C(s)+2NO(g)  N2(g)+CO2(g)△H=QkJ/mol。 在T1℃时,反应进行到不同时间(min) 测得各物质的浓度(mol/L) 如下:
N2(g)+CO2(g)△H=QkJ/mol。 在T1℃时,反应进行到不同时间(min) 测得各物质的浓度(mol/L) 如下:
| 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①30min 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________(填字母编号)
a.通入一定量的NO b.加入定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
② 若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3: 1: 1,则Q_____ 0 (填“>”或“<”<)。
(2) 某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,则得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应:NO+CO N2+CO2( 有CO) 2NO
N2+CO2( 有CO) 2NO N2+ O2 (无CO)
N2+ O2 (无CO)
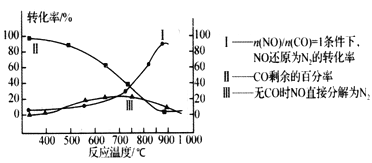
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为: __________;在n(NO)/n(CO)= 1的条件下,应控制最佳温度在_______左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,写出C2H6与NO2发生反应的化学方程式_________________。
③以NO2、O2 熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电极反应式为__________________。
(3) 天然气的一个重要用途是制取氢气,其原理如下:
已知:① 2CO(g)+O2(g)=2CO2(g) △H1
②CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) △H2
③2H2(g)+O2(g)=2H2O(l) △H3
1)科学家提出一种利用天然气制备氢气的方法: CH4(g)+ CO2(g)=2CO(g)+2H2(g) △H=_____
2)这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是_________。
-
研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知: CO可将部分氮的氧化物还原为N2。
反应I :2CO(g)+2NO(g)  N2(g)+2CO2(g) △H=-746kJ.mol-1
N2(g)+2CO2(g) △H=-746kJ.mol-1
反应II :4CO(g)+2NO2(g)  N2(g)+4CO2(g) △H=-1200kJ.mol-1
N2(g)+4CO2(g) △H=-1200kJ.mol-1
则反应NO2(g)+CO(g)  CO2(g)+NO(g)的△H=______kJ/mol。
CO2(g)+NO(g)的△H=______kJ/mol。
(2)一定条件下,将NO2与CO以体积比1:2置于密闭容器中发生反应II,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.每消耗2molNO2的同时生成1molN2
(3)温度为T、容积为10L的恒容密闭容器中,充入1molCO和0.5 mol SO2发生反应:2CO(g)+SO2(g) 2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:
2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:

①达到平衡状态时,SO2的转化率为__,该温度下反应的平衡常数K=______。
②其它条件保持不变,再向上述平衡体系中充入SO2(g).CO(g)、S(g)、CO2(g)各0.2mol,此时v(正)___v(逆) (填“>”“<”或“=”)。
(4)SCR法是工业上消除氦氧化物的常用方法,反应原理为4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:
4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:
图中A点处NO的转化率_______(填“可能是”、“一定是 ”或“一定不是”)该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是________。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应活化能增大
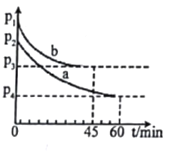
(5)2SO2(g)+O2(g)  2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。
2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。