-
(20分)碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。请回答:
(1)消除汽车尾气中的NO、CO,有利于减少对环境的污染。已知如下信息:
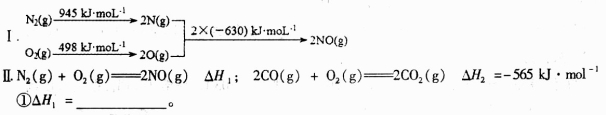
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式___________________。
(2)在催化剂作用下,CO2和H2可以制取甲醇,在体积为2L的密闭容器中,充入lmolCO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0
CH3OH(g)+H2O(g) △H<0
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如下图所示:
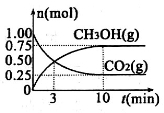
①从反应开始到平衡,H2O的平均反应速率v(H2O)=_________________________。此反应的平衡常数为_________________。
②下列措施中能使化学平衡向正反应方向移动的是_________________(填序号)
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入1 molCO2和4molH2
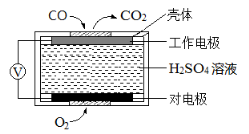
(3)用间接电化学法除去NO的过程,如图所示:已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:____________。用离子方程式表示吸收池中除去NO的原理:________________。

(4)①工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是,用文字和化学用语解释原因__________________。
②废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于C12的尾气处理,吸收C12后的溶液仍呈强碱性。则吸收C12后的溶液中一定存在的阴离子有OH-_____、_____;还可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液。此实验不能证明溶液中含有SO32-,理由是:________________(用离子方程式表示)。
-
(18分)碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
I.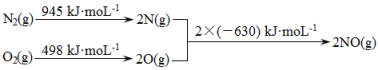
II.N2(g)+ O2(g)  2NO(g) ΔH1
2NO(g) ΔH1
2CO(g) + O2(g) 2CO2 (g) ΔH2= -565 kJ·mol-1
2CO2 (g) ΔH2= -565 kJ·mol-1
①ΔH1= 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式 。
(2)电化学气敏传感器法测定汽车尾气。其中CO传感器的工作原理如图所示,则工作电极的反应式为
(3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是 ,用文字和化学用语解释原因 。
(4)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化 b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化 d.生成CO2的速率与消耗CO的速率相等
②l0 min内,反应的平均反应速率v (CO2)= 。
③T℃时,该反应的平衡常数K= 。
-
(13分)碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
I.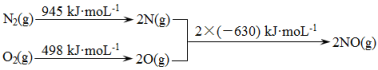
II.N2(g)+ O2(g)  2NO(g) ΔH1
2NO(g) ΔH1
2CO(g) + O2(g) 2CO2 (g) ΔH2= -565 kJ·mol-1
2CO2 (g) ΔH2= -565 kJ·mol-1
①ΔH1= 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式
③一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。
温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是
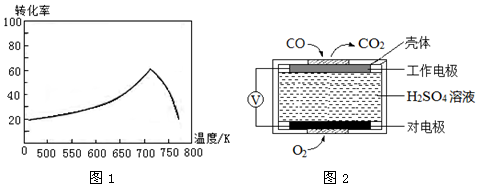
(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为
②方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式
(3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是,用文字和化学用语解释原因 。
-
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。消除汽车尾气中的NO、CO,有利于减少PM2.5 的排放。已知如下信息:
①2CO(g)+2NO(g) 2CO2(g)+N2(g) △H1=- 748kJ/mol
2CO2(g)+N2(g) △H1=- 748kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-565kJ/mol
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:______________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L 恒容密闭容器中加入0.2moINO 和0.3moICO,在催化剂存在的条件下发生反应①,10min 时反应达到平衡,测得10min 内v(NO)=7.5×10-3mol/(L•min),则平衡后CO 的转化率为_______________。
(3)其他条件相同,t min 时不同温度下测得NO 的转化率如图( I)所示。A 点的反应速率v正___(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是_______(填“A”或“B”),理由是__________________。
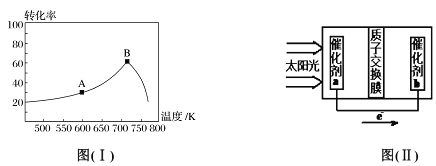
(4)已知常温下: Ka(HNO2)=7.1×10-4mol/L;Kb(NH3·H2O)=1.7×10-5mol/L。0.1mol/LNH4NO2溶液中离子浓度由大到小的顺序是_________,常温下NO2-水解反应的平衡常数K=____。
(5)人工光合作用能够借助太阳能用CO2和水制备化学原料,图(II )是通过人工光合作用制备HCOOH 的原理示意图,请写出催化剂b处的电极反应式:______________。
-
(1 7分)碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g) 2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO气体,写出反应的热化学方程式________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol/(L·min),则平衡后n(CO)=________mol,关于该平衡的下列说法正确的是________。
a.增大压强,平衡一定向右移动
b.其它条件不变,升高温度,化学反应速率一定增大
c.其它条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.向平衡后的容器中再充人0. 2mol NO和0.1mol CO,化学平衡常数增大
e.达到平衡后v正(NO)=2v逆(N2)
(3)其它条件相同,tmin时不同温度下测得NO的转化率如图所示。A点的反应速率v正________v逆(填“>”“<”或“="),A、B两点反应的平衡常数较大的是_________(填“A”或“B")。
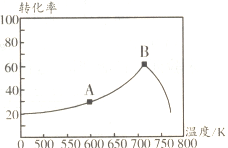
(4)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,试分析原因:________.0.1mol·L-1NH4NO3溶液中离子浓度由大到小的顺序是________,常温下NO2-水解反应的平衡常数Kh=________mol  (保留两位有效数字)。
(保留两位有效数字)。
(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数=1.7×10-5mol·L-1)
-
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:_________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,则平衡后n(CO)=________mol,关于该平衡的下列说法正确的是________。
a.增大压强,平衡一定向右移动
b.其他条件不变,升高温度,化学反应速率一定增大
c.其他条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.达到平衡后v正(NO)=2v逆(N2)
(3)其他条件相同,t min时不同温度下测得NO的转化率如图所示。
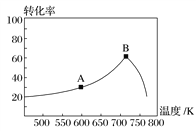
A点的反应速度v正________(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是________(填“A”或“B”)。
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;
NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
则0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是____________________________,
常温下NO2-水解反应的平衡常数Kh=________(保留两位有效数字)。
-
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:_________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,则平衡后n(CO)=________mol,关于该平衡的下列说法正确的是________。
a.增大压强,平衡一定向右移动
b.其他条件不变,升高温度,化学反应速率一定增大
c.其他条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.达到平衡后v正(NO)=2v逆(N2)
(3)其他条件相同,t min时不同温度下测得NO的转化率如图所示。
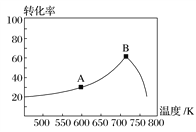
A点的反应速度v正________(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是________(填“A”或“B”)。
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;
NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
则0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是____________________________,
常温下NO2-水解反应的平衡常数Kh=________(保留两位有效数字)。
-
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:_________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,则平衡后n(CO)=________mol,关于该平衡的下列说法正确的是________。
a.增大压强,平衡一定向右移动
b.其他条件不变,升高温度,化学反应速率一定增大
c.其他条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.达到平衡后v正(NO)=2v逆(N2)
(3)其他条件相同,t min时不同温度下测得NO的转化率如图所示。
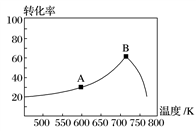
A点的反应速度v正________(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是________(填“A”或“B”)。
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;
NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
则0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是____________________________,
常温下NO2-水解反应的平衡常数Kh=________(保留两位有效数字)。
-
氮的氧化物和硫的氧化物是主要的大气污染物,烟气脱硫脱硝是环境治理的热点问题。回答下列问题:
(1)目前柴油汽车都用尿素水解液消除汽车尾气中的NO,水解液中的NH3将NO还原为无害的物质。该反应中氧化剂与还原剂物质的量之比为___。
(2)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO42-。
①KMnO4脱硫(SO2)的离子方程式为___。
②加入CaCO3的作用是___。
③KMnO4/CaCO3浆液中KMnO4与CaCO3最合适的物质的量之比为___。
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如图所示:
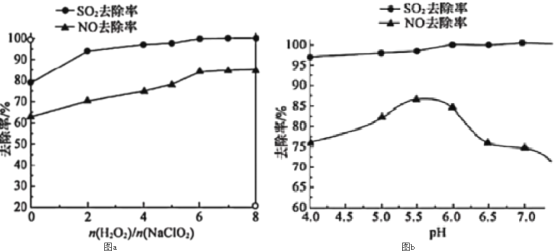
图a和图b中可知脱硫脱硝最佳条件是___。图b中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是___。
-
下列说法不正确的是
A、化学是以实验为基础的一门学科,定量研究方法是化学发展为一门独立学科的重要标志之一
B、燃煤脱硫、汽车中加装尾气处理装置、利用二氧化碳制造全降解塑料、推广新能源汽车都能有效减少环境污染
C、我国科学家屠呦呦发现的青蒿素(结构见右图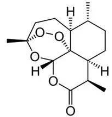 ),其中有类似于H2O2的结构,因此遇到强还原性的物质会变质
),其中有类似于H2O2的结构,因此遇到强还原性的物质会变质
D、利用氢氧化铁胶体的“丁达尔效应”,可以除去水中的悬浮颗粒,从而达到净水的效果
2CO2(g)+N2(g) △H=-748kJ·mol-1

(保留两位有效数字)。
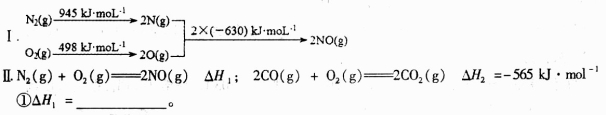


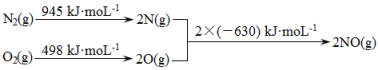

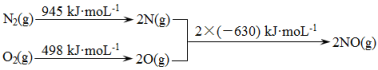






 ),其中有类似于H2O2的结构,因此遇到强还原性的物质会变质
),其中有类似于H2O2的结构,因此遇到强还原性的物质会变质