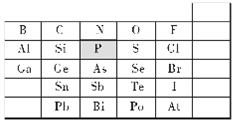-
(7分)
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
(1)阴影部分元素N在元素周期表中的位置为________周期________族 。 根据元素周期律,预测:酸性强弱 H3AsO4 ________H3PO4。(用“>”或“<”表示)
(2)元素Se的最高正价和最低负价的代数和为____________; 在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度________ 。(选填“更大”、“更小”或“相同”);
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是_____________。
(4)下列说法不正确的是________。
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
-
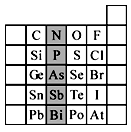
(14分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
(1)阴影部分元素N在元素周期表中的位置为________。
根据元素周期律,预测:酸性强弱 H3AsO4 ________H3PO4。(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为______,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度________(选填“更大”、“更小”或“相同”) 。
(3)O原子与氢原子可形成10电子阴离子,写出该阴离子的电子式________
(4)Cl2、Br2、I2均可从中海洋提取,Br2的提取是采用向酸化的浓海水中通入Cl2置换出Br-的方法而获得,有关的离子方程式为________,利用Br2具有较强的氧化性,SO2具有较强的还原性,将吹出的Br2通入溶有SO2气体的溶液中,进行溴的富集,此时溶液中存在的主要离子是____________________________。
-
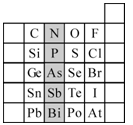
(10分)元素在周期表中的位置,反映了元素的原子结构和元素性质。下图是元素周期表的一部分。

(1)阴影部分中元素N在元素周期表中的位置为第________周期________族,其单质分子中含有的共用电子对数目为________对。
(2)根据元素周期律,请你预测H3AsO4、H3PO4、
的酸性强弱:H3AsO4________ H3PO4(填“>”、“<”或“=”)。
(3)在一定条件下,S、Se都能与H2反应,根据元素周期律判断,Se与H2反应比S与H2的反应________。(填“更难”或“更易”)
-
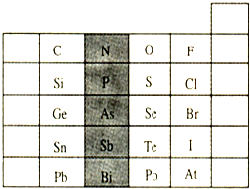
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
(1)阴影部分元素N在元素周期表中的位置为______.
根据元素周期律,请你预测:H3AsO4、H3PO4的酸性强弱:H3AsO4______H3PO4.(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为______、______,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下,等物质的量的S和Se分别与等量的H2反应,生成气态氢化物的物质的量______.
(a) H2S<H2Se (b) H2S>H2Se (c) H2S=H2Se
(3)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子的形成过程:______.
(4)试在表上画出金属和非金属的分界线______.
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分。
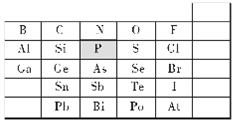
(1)请用实线在图中画出金属与非金属的分界线;
(2)阴影部分中P 元素在元素周期表中的位置为________;H2SO4、H3AsO4、H3PO4酸性由强到弱的顺序是____________;
(3)卤族元素对应的氢化物沸点递变规律正确的是_______;
A.HF<HCl<HBr<HI B.HCl<HBr<HI<HF
(4)氢化物的稳定性H2Se_____H2S (填“<”、“>”或“=”)。
(5)稼(Ga)和同族的铝具有相似的化学性质,请写出稼与沸水反应的化学方程式____________。
-
(10分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
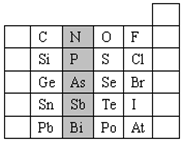
(1)阴影部分元素N的最高价氧化物为 。根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:
H3AsO4________H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为________、 ________,
(3)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度________(选填“更大”、“更小”或“相同”)。
(4)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构。请写出羰基硫分子的电子式 ________
(5)单质砷和热的浓H2SO4反应,生成As2O3,反应的化学方程式为 ________________________ ;
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质。如图是元素周期表的一部分。
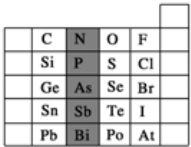
(1)阴影部分元素P在元素周期表中的位置为 。根据元素周期律预测:酸性强弱H3PO4 H3AsO4。(用“>”“<”或“=”表示)
(2)已知阴影部分As元素的原子核内质子数为33,则Sn2+ 的核外电子数为 。
(3)下列说法正确的是 。
A.C、N、O、F的原子半径随着原子序数的增大而增大
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.对于短周期元素,两种简单离子不可能相差3个电子层
D.HF、HCl、HBr、HI的还原性依次减弱
(4)在离子RO3n-中含有x个核外电子,R原子的质量数为A,则R原子中子数是 。
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。

(1)阴影部分元素在元素周期表中的位置为________族。
(2)根据元素周期律预测:H3AsO4属于强酸还是弱酸?________。
(3)C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,其原因是_________________________________________。
试写出Si的氢化物完全燃烧的化学方程式:______________________________。
(4)O2与H2的反应是不可逆反应,而S与H2反应有一定限度,请写出Se与H2反应的化学方程式:______________________
(5)试比较S、O、F三种元素的原子半径大小:________(填元素符号)。
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
(1)阴影部分元素在元素周期表中的位置为________族.
(2)根据元素周期律预测:H3AsO4属于强酸还是弱酸?________
(3)C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,试写出其完全燃烧的方程式________
(4)O2与H2的反应是不可逆反应,而S与H2反应有一定限度,请写出Se与H2反应的化学方程式________
(5)试比较S、O、F三种元素的原子半径大小:________(填元素符号).

-
元素在周期表中的位置,反映了元素的原子结构和元素的性质。如图是元素周期表的一部分。
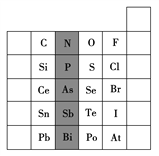
(1)阴影部分元素N在元素周期表中的位置为____周期第____族。根据元素周期律,预测酸性强弱:H3AsO4____H3PO4(填“>”或“<”)。
(2)S的最高化合价和最低化合价的代数和为____,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的程度比S与H2反应程度____(填“更大”“更小”或“相同”)。
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是____。
(4)下列说法错误的是____(填序号)。
①C、N、O、F的原子半径随着原子序数的增大而减小
②Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
③干冰升华、液态水转变为气态水都要克服分子内的共价键
④HF、HCl、HBr、HI的热稳定性依次减弱