-
为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制50 mL 1.0 mol·L−1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L−1。
① 用化学用语解释FeCl3溶液呈酸性的原因: 。
② 下列实验方案中,能使FeCl3溶液pH升高的是 (填字母序号)。
a. 加水稀释 b. 加入FeCl3固体
c. 滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作
现象
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L−1的FeCl3溶液,搅拌
溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体
收集检验反应过程中产生的气体
集气管口靠近火焰,有爆鸣声
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因: 。
② 用离子方程式解释反应后溶液为浅绿色的原因: 。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是 。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是 。
(3)为进一步探究上述1.0 mol·L−1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
操作
现象
将5 mL 1.0 mol·L−1的FeCl3溶液与0.65 g锌粉混合
溶液温度迅速上升,开始时几乎没有气泡
将 与0.65 g锌粉混合
溶液中立即产生大量气泡
小组同学得出结论:在1.0 mol·L−1 FeCl3溶液中,Fe3+的氧化性比H+更强。
高三化学实验题简单题查看答案及解析
-
某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1 mol/L HCl溶液、1滴1 mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如下图所示。
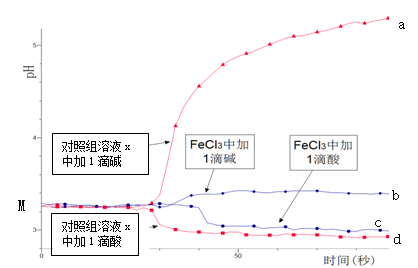
下列说法不正确的是
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液x的组成可能是0.003 mol/L KCl
C.依据曲线c和d说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
高三化学选择题困难题查看答案及解析
-
某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1 mol/L HCl溶液、1滴1 mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如下图所示。
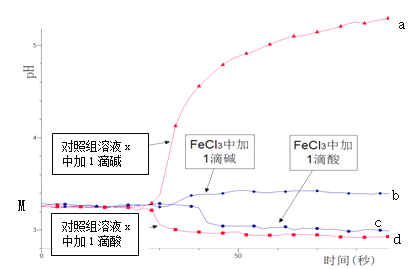
下列说法不正确的是
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液x的组成可能是0.003 mol/L KCl
C.依据曲线c和d说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
高三化学单选题中等难度题查看答案及解析
-
某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1 mol/L HCl溶液、1滴1 mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如下图所示。
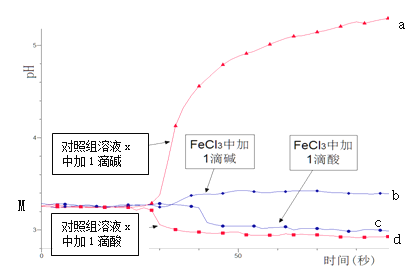
下列说法不正确的是
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液x的组成可能是0.003 mol/L KCl
C.依据曲线c和d说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
高三化学单选题中等难度题查看答案及解析
-
某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1 mol/L HCl溶液、1滴1 mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如下图所示。
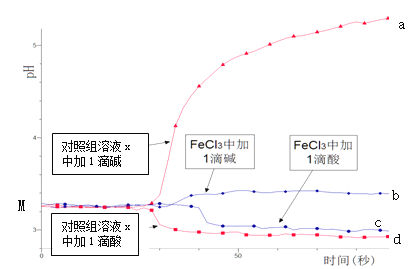
下列说法不正确的是
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液x的组成可能是0.003 mol/L KCl
C.依据曲线c和d说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
高三化学单选题中等难度题查看答案及解析
-
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
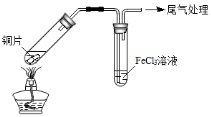
A B
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、 。
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤①
配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装
入试管B中,加热A。
写出装置A中产生SO2的化学方程式: 。
(4)当SO2通
入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因(用化学用语解释): 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:
。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学
进行了步骤③的实验。
步骤②
往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶
液颜色变为浅绿色。
步骤③
往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO
2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。
⑹综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
高三化学实验题困难题查看答案及解析
-
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
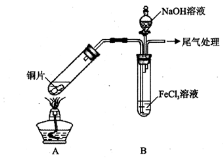
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 。
(3)该小组同学向5mL lmol/L FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是 。
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO
。SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因是 ;Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mo1·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为________________。(忽略过程中溶液的体积变化)
高三化学实验题困难题查看答案及解析
-
(12分)某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
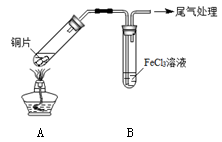
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤①
配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。
FeCl3溶液显酸性的原因是_________。写出装置A中产生SO2的化学方程式:_________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:_____________________。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:______________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
步骤②
往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。
步骤③
往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为_______________。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III._________________________________。
高三化学实验题困难题查看答案及解析
-
某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号
操作
现象
实验Ⅰ
取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5∼6滴(混合溶液pH=5)
溶液变为棕黄色
实验Ⅱ
取2mL实验Ⅰ反应后的溶液,滴加2滴0.1mol⋅L−1 KSCN溶液
溶液呈红色
(1)证明实验Ⅰ中有Fe2+ 生成,加入的试剂为____________________________。
(2)写出实验Ⅰ反应的离子方程式:_____________________________________。
(3)上述实验现象可以证明Fe3+与I−发生可逆反应,实验Ⅰ在用量上的用意是__________
(4)在实验I的溶液中加入CCl4,实验现象是____________________________,取其上层清液中滴加KSCN溶液,并未看到明显的红色,其原因为(从平衡移动的角度解释)_________________________________________________________。
(深入探究)20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I−可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I−氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:____________________________________,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是__________________________。
高三化学实验题困难题查看答案及解析
-
(15分)已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
实验
1
实验步骤
实验现象
ⅰ.取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。
ⅰ.溶液呈棕黄色。
ⅱ.向其中滴加2滴0.1 mol·L-1 KSCN溶液。
ⅱ.溶液不显红色。
①写出FeCl3溶液与KI溶液反应的离子方程式 。
②加入KSCN溶液的目的是 。
③甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2。
实验
2
实验步骤
实验现象
ⅰ.取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。
ⅰ.溶液呈棕黄色。
ⅱ.向其中滴加2滴0.1 mol·L-1 KSCN溶液。
ⅱ.溶液显红色。
ⅲ.继续加入2 mL CCl4,充分振荡、静置。
ⅲ.液体分层,上层红色消失,变为棕黄色,下层呈紫红色。
本实验改用0.1 mol·L-1 KI溶液的目的是 。用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因: 。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I-
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
①为验证假设,乙同学设计并完成了实验3。
实验3
实验步骤
实验现象
ⅰ.取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。
ⅰ.液体分层,上层呈黄色,下层呈紫红色。
ⅱ.取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。
ⅱ.液体分层,上层为无色,下层呈紫红色。
实验3的结论是 。
②甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中 。
两支试管中的现象分别为 。
高三化学实验题极难题查看答案及解析