-
(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、速凝于一体的新型多功能水处理剂。其生产流程如下:

(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KclO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为 mol。从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
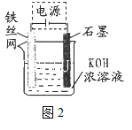
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图2所示。电解过程中阳极的电极反应式为 。
-
(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、速凝于一体的新型多功能水处理剂。其生产流程如下:

(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为 mol。从溶液Ⅱ中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图2所示。电解过程中阳极的电极反应式为 。

-
(8分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产流程如下:
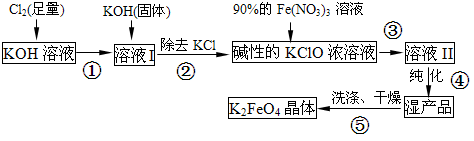
(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL), 它的物质的量浓度是 ____mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KclO
(3)从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气
体单质,请写出该反应的离子方程式: 。
-
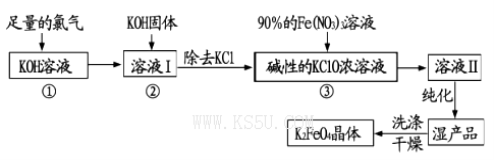
(10分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
请同答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
A.为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液I中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为_______。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为____ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:___ FeO42-+___ H2O=___ Fe(OH)3(胶体)+_____O2↑+___OH-。
-
(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
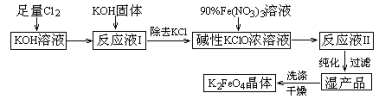
已知:① 2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 — Zn电池类似,K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
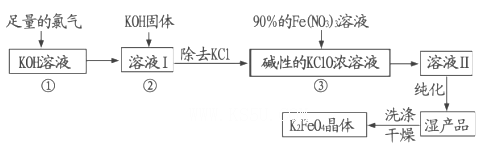
请同答下列问题:
(l)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
A.为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液I中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为_______。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为____ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_______ FeO42-+_______ H2O=_______ Fe(OH)3(胶体)+_______O2↑+_______OH-。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为________。
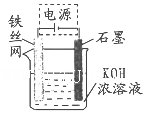
(6)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:3Zn(OH)2+2Fe(OH)3+4KOH-----3Zn+2K2FeO4+8H2O,放电时电池的负极反应式为________ 。
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
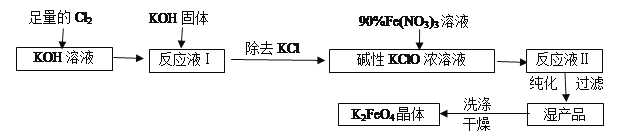
请回答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式___________。
(2)在溶液Ⅰ中加入KOH固体的目的是________ (填编号)。
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3) 从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为________。每制得59.4 克K2FeO4,理论上消耗氧化剂的物质的量为________mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式: FeO42-+ H2O= Fe(OH)3(胶体) + O2↑+ OH-。___________
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为_____________。
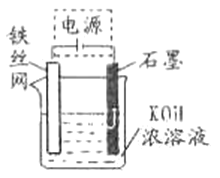
-
【化学--选修2化学与技术】(15分)
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
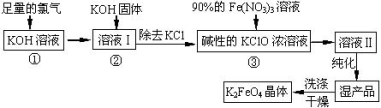
已知:2KOH + Cl2 ═ KCl + KClO + H2O(条件:温度较低)
6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体( 该溶液的密度为1.47 g/mL),它
的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
A.与 “溶液I” 中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,还会有副产品 (写化学式),它们都是重要的化工 产 品,具体说出其中一种物质的用途 (答1点即可); 则反应③中发生的离子反应方程式为 。
(7)如何判断K2FeO4晶体已经洗涤干净 。
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
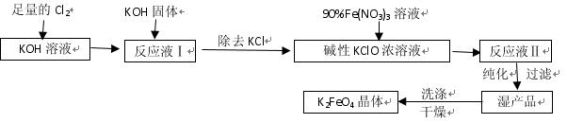
已知:① 2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)在“反应液I”中加KOH固体的目的是 :
(4)加入硝酸铁溶液生成反应液Ⅱ的化学方程式:
(5)从“反应液Ⅱ”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
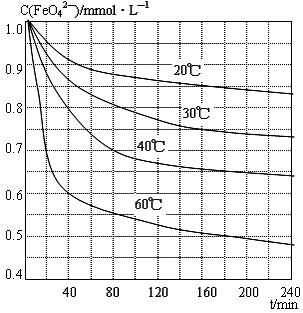
(6)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
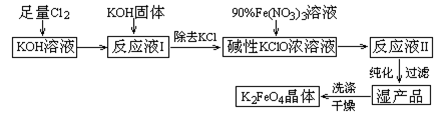
已知:① 2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在________(填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式________;
(3)K2FeO4可作为新型多功能水处理剂的原因________;
(4)与MnO2 - Zn电池类似,K2FeO4 - Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是①________,②________;
(6)从“反应液II ”中分离出K2FeO4后,副产品是________(写化学式)。














