-
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用废铁屑等物质为原料制备,并测定产品的纯度。相关反应的化学方程式为:Fe + H2SO4 =FeSO4 + H2↑ FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟,其目的是 。然后使用 (填写操作名称)分离并洗涤铁屑。
(2)析出的K3[Fe(C2O4)3]·3H2O晶体可通过如下图所示装置通过减压过滤与母液分离。下列关于减压过滤的操作正确的是 。
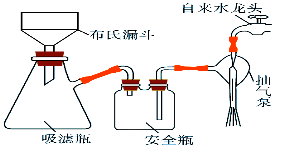
A.选择比布氏漏斗内径略小又能将全部小孔 盖住的滤纸
B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸
(3)使用高锰酸钾法(一种氧化还原反应滴定法)可以测定所得产品的纯度。若需配制浓度为0.03000 mol·L-1KMnO4标准溶液240mL,应准确称取 g KMnO4(保留四位有效数字,已知M KMnO4=158.0g.mol-1)。配制该标准溶液时,所需仪器除电子天平、药匙、烧杯、玻璃棒外,还缺少的玻璃仪器有 。配制过程中,俯视刻度线定容则导致所配溶液浓度 (填“偏大”、“偏小”或“无影响”)。
(4)某同学称取2.000g产品,经预处理后配制成100mL溶液,移取25.00mL溶液于锥形瓶中,使用0.03000 mol·L-1KMnO4标准溶液滴定,消耗标准溶液10.00mL。
①实际进行滴定时,往往使用酸化的KMnO4标准溶液,写出该滴定反应的离子方程式 。
②判断到达滴定终点的现象是 。
③该产品的纯度为 ﹪(保留四位有效数字)。
-
K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下。请回答下列问题:
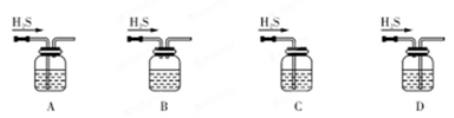
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 (填序号)。
(2)在得到的FeSO4溶液中需加入少量的H2 SO4酸化,目的是 ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤⑤的目的是 。
(4)C2O 可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
①写出滴定过程中发生反应的离子方程式 。
②下列滴定操作中使滴定结果偏高的是 (填序号)。
A.滴定管用蒸馏水洗涤后,立即装入标准液
B.锥形瓶在装待测液前未用待测液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数
③取产物10.0 g配成100 mL溶液,从中取出20 mL于锥形瓶中,用浓度为0.1mol·L-l的酸性KMnO4溶液滴定,达到滴定终点时消耗酸性KMnO4溶液24.00mL,则产物中K3 [Fe(C2O4)3]·3H2O的质量分数为 [已知摩尔质量M{ K3[Fe(C2O4)3]·3H2O)=491 g·mol-l]。
-
K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:Fe+H2SO4 FeSO4+H2↑
FeSO4+H2↑
FeSO4+H2C2O4+2H2O FeC2O4·2H2O↓+H2SO4
FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4 2K3[Fe(C2O4)3]+6H2O
2K3[Fe(C2O4)3]+6H2O
2Mn +5C2
+5C2 +16H+
+16H+ 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
回答下列问题:
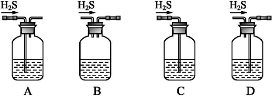
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 。
(2)在将Fe2+氧化的过程中,需控制溶液温度不高于40 ℃,理由是 ;得到K3[Fe(C2O4)3]溶液后,加入乙醇的理由是 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤ (叙述此步操作),⑥计算。步骤③若未在干燥器中进行,测得的晶体中所含结晶水含量 (填“偏高”“偏低”或“无影响”);步骤⑤的目的是 。
(4)晶体中C2 含量的测定可用酸性KMnO4标准溶液滴定。称取三草酸合铁(Ⅲ)酸钾晶体m g溶于水配成250 mL溶液,取出20.00 mL放入锥形瓶中,用0.010 0 mol·L-1酸化的高锰酸钾溶液进行滴定。
含量的测定可用酸性KMnO4标准溶液滴定。称取三草酸合铁(Ⅲ)酸钾晶体m g溶于水配成250 mL溶液,取出20.00 mL放入锥形瓶中,用0.010 0 mol·L-1酸化的高锰酸钾溶液进行滴定。
①下列操作及说法正确的是 。
A.滴定管用蒸馏水洗涤后,即可装入标准溶液
B.装入标准溶液后,把滴定管夹在滴定管夹上,轻轻转动活塞,放出少量标准液,使尖嘴充满液体
C.接近终点时,需用蒸馏水冲洗瓶壁和滴定管尖端悬挂的液滴
②有同学认为该滴定过程不需要指示剂,那么滴定终点的现象为 ,若达到滴定终点消耗高锰酸钾溶液V mL,那么晶体中所含C2 的质量分数为 (用含V、m的式子表示)。
的质量分数为 (用含V、m的式子表示)。
-
K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑、FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4、2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O、2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O。回答下列问题:
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是_____。
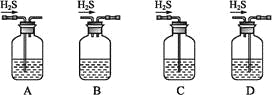
(2)在将Fe2+氧化的过程中,需控制溶液温度不高于40 ℃,理由是_______;得到K3[Fe(C2O4)3]溶液后,加入乙醇的理由是________。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤__________(叙述此步操作),⑥计算。步骤③若未在干燥器中进行,测得的晶体中所含结晶水含量____(填“偏高”“偏低”或“无影响”);步骤⑤的目的是_______________。
(4)晶体中C2O42-含量的测定可用酸性KMnO4标准溶液滴定。称取三草酸合铁(Ⅲ)酸钾晶体m g溶于水配成250 mL溶液,取出20.00 mL放入锥形瓶中,用0.010 0 mol·L-1酸化的高锰酸钾溶液进行滴定。
①下列操作及说法正确的是___。
A.滴定管用蒸馏水洗涤后,即可装入标准溶液
B.装入标准溶液后,把滴定管夹在滴定管夹上,轻轻转动活塞,放出少量标准液,使尖嘴充满液体
C.接近终点时,需用蒸馏水冲洗瓶壁和滴定管尖端悬挂的液滴
②有同学认为该滴定过程不需要指示剂,那么滴定终点的现象为________,若达到滴定终点消耗高锰酸钾溶液V mL,那么晶体中所含C2O42-的质量分数为____(用含V、m的式子表示)。
-
三草酸合-铁(III)酸钾K3 [Fe(C2O4)3]·3H2O (Mr=491)为绿色晶体,易溶于水,难溶于乙醇等有机溶剂。110℃下可失去结晶水,230℃时即分解,是制备负载型活性铁催化剂的主要原料。以硫酸亚铁铵为原料制备三草酸合铁(III)酸钾晶体的流程如下所示:
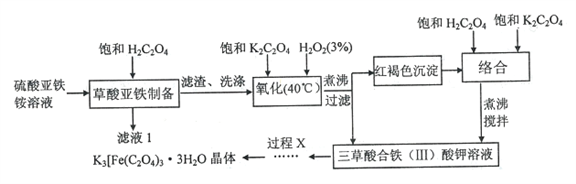
请回答下列问题:
(1)实验室中也可用Fe3+盐代替硫酸亚铁铵来制备该晶体,需先用碱液沉淀Fe3+,若用同浓度的NaOH溶液或氨水通过相同操作来沉淀,选择______能获得颗粒较大的Fe(OH)3。
(2)氧化过程中采用水浴加热,控制最佳温度为40℃,理由是_______,发生反应的化学方程式为_______。氧化完全后需将所得溶液煮沸,目的是__________________。
(3)关于过程X的下列说法中不正确的是________________。
A.可采用冷却和向溶液中加入乙醇的方法促使晶体析出
B.为了快速得到较干燥的固体,可以采用抽滤的方法
C.洗涤晶体时,可先用少量水洗,再用乙醇洗
D.可用加热烘干的方法得到较干燥的晶体
(4)为了分析产品纯度,进行如下操作:
准确称取产品0.9350g,配制成250mL溶液。每次移取25.00mL置于锥形瓶中,加入足量稀H2SO4酸化,将C2O42-转化为H2C2O4,用0.0100mol/LKMnO4溶液滴定至终点,现象是_______。平行测定三次,消耗KMnO4的体积分别为20.02mL,19.98mL,20.00mL,则所得粗产品的纯度为_________________。(已知:5 H2C2O4+2 MnO4-+6H+=10CO2↑+2Mn2++8H2O)
-
K3[Fe(C2O4)3]· 3H2O(三草酸合铁酸钾晶体)为翠绿色晶体, 溶于水, 难溶于乙醇, 110℃下失去结晶水,230℃分解;是制备负载型活性铁催化剂的主要原料。 实验室利用(NH4)2Fe(SO4)2· 6H2O (硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、30%双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:
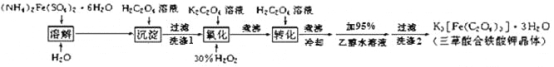
已知:沉淀FeC2O4 · 2H2O 既难溶于水又难溶于强酸
6FeC2O4 + 3H2O2 + 6K2C2O4 = 4K3[Fe(C2O4)3] + 2Fe(OH)3↓
2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O
(1)检验硫酸亚铁铵是否变质的试剂是_____;溶解时加几滴稀硫酸的目的是______。
(2)硫酸亚铁铵溶液与 H2C2O4溶液反应生成 FeC2O4 · 2H2O 沉淀,写出该反应方程式_______________;沉淀过滤后,洗涤 1 的操作方法是_______________________________。
(3)在沉淀中加入饱和 K2C2O4 溶液,并用 40 ℃ 左右水浴加热,再向其中慢慢滴加足量的 30% H2O2溶液,不断搅拌。此过程需保持温度在 40 ℃ 左右,可能的原因是_______。加入30%过氧化氢溶液完全反应后,煮沸的目的是______________。
(4)洗涤 2 中所用洗涤试剂最合适的是_______(填选项字母)。
A.草酸钠溶液 B.蒸馏水 C.乙醇 D.KCl溶液
(5)为了不浪费药品,95%乙醇水溶液进行回收的方法是________,所用的主要玻璃仪器有__________(任写两种)等。
-
K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐[(NH4)2Fe(SO4)2·6H2O]制备K3[Fe(C2O4)3]·3H2O具体流程如图:
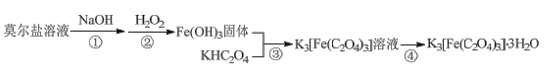
回答下列问题:
(1)步骤②滴加过量6%H2O2,生成红褐色胶状沉淀,该反应的化学方程式为___。生成的沉淀不易过滤,过滤前需要的操作是___。
(2)步骤③将Fe(OH)3加入到KHC2O4溶液中,水浴加热,控制pH为3.5-4,若pH偏高应加入适量___(填“H2C2O4”或“K2C2O4”)。
(3)步骤④的操作是___、过滤。得到的晶体依次用少量冰水、95%乙醇洗涤,用95%乙醇洗涤的目的是___。
(4)测定K3[Fe(C2O4)3]·3H2O中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点。滴定反应的氧化产物为___。滴定时,盛放高锰酸钾溶液的仪器是___(“酸式”或“碱式”)滴定管。
②向上述溶液中加入过量锌粉至将铁元素全部还原为Fe2+后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该样品中铁的质量分数的表达式为___。
-
(15 分)K3[Fe(C2O4)3]· 3H2O(三草酸合铁酸钾晶体)为翠绿色晶体, 溶于水, 难溶于乙醇, 110℃下失去结晶水,230℃分解;是制备负载型活性铁催化剂的主要原料。 实验室利用(NH4)2Fe(SO4)2· 6H2O (硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、30%双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:
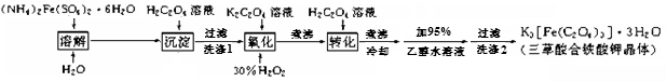
已知:沉淀:FeC2O4 · 2H2O 既难溶于水又难溶于强酸
6FeC2O4 + 3H2O2 + 6K2C2O4 = 4K3[Fe(C2O4)3] + 2Fe(OH)3↓
2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O
(1)检验硫酸亚铁铵是否变质的试剂是 ;溶解时加几滴稀硫酸的目的是 。
(2)硫酸亚铁铵溶液与 H2C2O4 溶液反应生成 FeC2O4 · 2H2O 沉淀,写出该反应方程式 ;沉淀过滤后,洗涤 1 的操作方法是 。
(3)在沉淀中加入饱和 K2C2O4 溶液,并用 40 ℃ 左右水浴加热,再向其中慢慢滴加足量的 30% H2O2 溶液,不断搅拌。此过程需保持温度在 40 ℃ 左右,可能的原因是 。加入30%过氧化氢溶液完全反应后,煮沸的目的是 。
(4)洗涤 2 中所用洗涤试剂最合适的是 (填选项字母)。
A.草酸钠溶液 B.蒸馏水 C.乙醇 D.KCl 溶液
(5)为了不浪费药品,95%乙醇水溶液进行回收的方法是 ,所用的主要玻璃仪器有 (任写两种)等。
-
K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,溶于水,难溶于乙醇,110℃下失去结晶水,230℃分解;是制备负载型活性铁催化剂的主要原料。
实验室利用(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、30%双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:
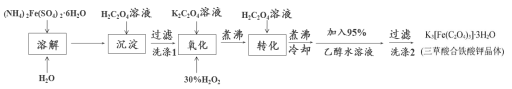
已知:沉淀: FeC2O4·2H2O既难溶于水又难溶于强酸
6FeC2O4+3H2O2+6K2C2O4 4K3[Fe(C2O4)3]+2Fe(OH)3↓
4K3[Fe(C2O4)3]+2Fe(OH)3↓
2Fe(OH)3+3H2C2O4+3K2C2O4 2K3[Fe(C2O4)3]+6H2O
2K3[Fe(C2O4)3]+6H2O
(1)检验硫酸亚铁铵是否变质的试剂是 ;溶解时加几滴稀硫酸的目的是 。
(2)沉淀过滤后,洗涤1的操作方法是 。
(3)在沉淀中加入饱和K2C2O4溶液,并用40 ℃ 左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌。此过程需保持温度在40 ℃ 左右,可能的原因是 。加入30%过氧化氢溶液完全反应后,煮沸的目的是 。
(4)洗涤2中所用洗涤试剂最合适的是 (填选项字母)。
A.草酸钠溶液 B.蒸馏水 C.乙醇 D.KCl溶液
-
K3[Fe(C2O4)3]·3H2O〔三草酸合铁(Ⅲ)酸钾晶体〕是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂。下图是在实验室制备K3[Fe(C2O4)3]·3H2O的流程:
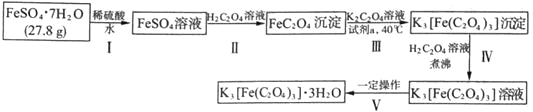
回答下列问题:
(1)步骤I中加入稀硫酸的目的是_______________。
步骤II中发生的主要化学反应为一可逆过程,其离子方程式为_______________。
常温下,该反应的平衡常数K=_______________[已知常温下:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=5.4×10-5、Ksp(FeC2O4)=2.1×10-7]
(2)下列试剂均可将FeC2O4氧化为K3[Fe(C2O4)3],最适宜作为“试剂a”的是_______________(填序号)
a.氯水b.酸性KMnO4溶液c.H2O2溶液d.稀硝酸
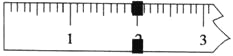
(3)使用托盘天平称量制得的K3[Fe(C2O4)3]·3H2O的质量。天平平衡时,右盘内砝码的总质量为20 g.游码示数如图所示,则制得晶体的质量为___________g,该实验中K3[Fe(C2O4)3]·3H2O的产率为_______________。(已知: K3[Fe(C2O4)3]·3H2O的相对分子质量为491,FeSO4·7H2O的相对分子质量为278)
(4)某研究小组将K3[Fe(C2O4)3〕在一定条件下加热分解后,利用下图所示装置(可重复使用)确认所得含碳元素的气体产物为CO和CO2。
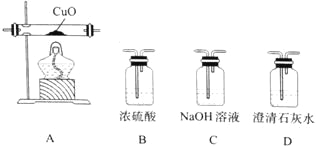
按气流从左到右的方向,装置的连接顺序为_______________(填装置序号) ;确认气体产物中含CO的现象为_______________。












