-
某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。
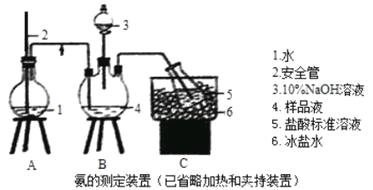
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将___(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是___________;滴定终点时,若溶液中c(Ag+)=2.0×10—5mol·L—1,c(CrO42—)为______mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为______,制备X的化学方程式为____________________;X的制备过程中温度不能过高的原因是__________________。
-
某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。

①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将___(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是___________;滴定终点时,若溶液中c(Ag+)=2.0×10—5mol·L—1,c(CrO42—)为______mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为______,制备X的化学方程式为____________________;X的制备过程中温度不能过高的原因是__________________。
-
某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。

①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1 mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
-
某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。

①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mL NaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题::
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1,c(CrO42-)为 mol·L-1。(已知:Ksp(Ag2CrO4)=1.12×10-12)
(6)经测定,样品X中钴.氨.氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
-
某实验小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,他们进行了如下实验:
①氨的测定:精确称取wgX,加适量水溶解,注入下图所示的蒸馏烧瓶中(夹持和加热仪器略去),然后逐滴加入足量10%NaOH溶液,加热烧瓶将氨蒸出,用V1mLc1mol·L-1的盐酸吸收蒸出的氨,然后取下锥形瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl。.终点时消耗V2 mLNaOH溶液。

②氯的测定:准确称取样品X配成溶液,用K2CrO4溶液为指示剂,用AgNO3标准溶液滴定,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)
回答下列问题:
(1)X的制备过程中,温度不能过高,其原因是____________________________
(2)仪器a的名称是________________;测定氨前应该对装置进行气密性检验,若气密性不好则测定结果将________(填“偏高”或“偏低”).该滴定过程中选择________做指示剂。
(3)样品中氨的质量分数表达式为_____________________________。
(4)测定氯的过程中,AgNO3标准溶液置于_________(填“无色”或“棕色”)滴定管中;滴定终点时,溶液中已检测不到Cl-[c(Cl-)≤1.0×10-5 mol·L-1],则出现砖红色沉淀时,溶液中c(CrO42-)的最小值为_____________mol·L-1。[已.知:Ksp(AgCl)=1.0×10-10,Ksp( Ag2CrO4)=1.12×10-12]
(5)经测定分析,样品X中钴、氨和氯的物质的量之比为1:6:3,则制备X的化学方程式为________________________________________。
(6)某同学向CoCl2溶液中加入足量(NH4)2C2O4得到CoC2O4沉淀,在空气中煅烧CoC2O4生成钻氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则所得钴氧化物的化学式为________________。
-
某小组以CoCl2•6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:
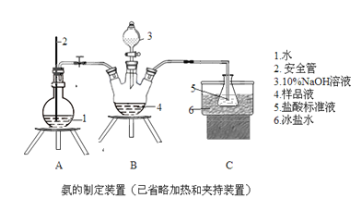
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1 mL c1 mol•L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2 mol•L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不在消失为终点(Ag2CrO4为砖红色)。 回答下列问题:
(1)装置中安全管的作用原理是___________________。
(2)用NaOH标准溶液滴定过剩的HCl时,一般选用的指示剂为___________。
(3)样品中氨的质量分数表达式为____________________。
(4)测定氯的过程中,使用棕色滴定管的原因是____________________。
(5)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为______。制备X的化学方程式为_____________。X的制备过程中温度不能过高的原因是___________。
-
(15分)某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1 mol·L—1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
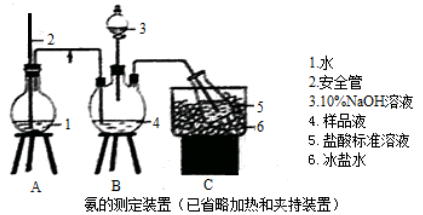
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴.氨.氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
-
(10分)某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol•L﹣1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L﹣1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液.

氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____________式滴定管,可使用的指示剂为____________。
(3)样品中氨的质量分数表达式为_____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将__________(填“偏高”或“偏低”)。
(5)测定氯过程中,使用棕色滴定管的原因是_________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol•L﹣1,c(CrO42-)为__________mol•L-1。已知:Ksp(Ag2CrO4)=1.12×10-12
(6)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,钴的化合价__________,制备X的化学方程式为__________;X的制备过程中温度不能过高的原因是__________。
-
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体X。为确定其组成,进行如下实验。
(1)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol/L的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mLNaOH溶液。

氨的测定装置(已省略加热和夹持装置)
①装置中安全管2的作用是 。盛10%NaOH溶液仪器3的名称是 。
②用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,用酚酞做指示剂,判断达到滴定终点时的现象为 。
③样品中氨的质量分数表达式为 。测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(2)氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol/L,则c(CrO42-)为 mol/L,(已知:Ksp(Ag2CrO4)=1.12×10-12)
(3)经测定,样品X中钴、氨和氯的物质的量比为1:6:3,又知X 的化学式类似于氢氧化二氨合银Ag(NH3)2OH,制备X的化学方程式为 。X的制备过程中温度不能过高的原因是 。
-
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
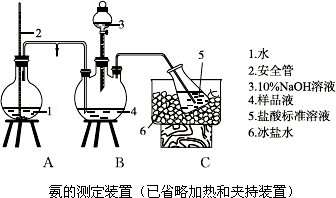
(1)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;
(2)氨的测定:精确称取w g X,加适量水溶解,注入如图2所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol•L﹣1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L﹣1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液.
①装置中安全管的作用原理是 .
②样品中氨的质量分数表达式为 .









