-
Cu、Ni、V为制造合金及合成催化剂的重要元素。 请回答:
(1)基态铜原子的电子排布式是_________________。基态铜原子价电子层排布依据的原理,可用于解释下列事实的是___________。
A.Fe2+易被氧化为Fe3+ B.铜丝灼烧时焰色呈绿色
C.N的第一电离能大于O的第一电离能 D.NaCl的熔点比KCl的高
(2)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为__________(任写一种)。NH3与CH4的VSPER构型相同,其中NH3的键角较小,原因是____________。Ni(CO)4中σ键和π键的数目之比为_________。
(3)钒的某种配合物有增强胰岛素和降糖作用,其分子结构如图所示。
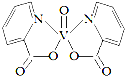
① 基态V元素的价层电子轨道表示式______________________,分子中非金属元素电负性由大到小的顺序为________。
② 该物质的晶体中除配位键外,所含微粒间作用力的类型还有___________(填序号)。
a.金属键 b.极性键 c.非极性键 d.范德华力 e.氢键
③ 1mol分子中含有配位键的数目是______,分子中采取sp2杂化的原子有_______。
-
氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.
请回答下列问题:
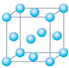
(1)写出铬原子的基态电子排布式________,与铬同周期的所有元素的 基态原子中最外层电子数与铬原子相同的元素有________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________.
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子.
(3)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________(填序号),CCl4分子的空间构型是________.
-
氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
请回答下列问题:
(1)写出铬原子的基态电子排布式________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________。
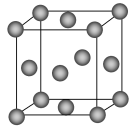
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
(3)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________(填序号),CS2分子的空间构型是________。
-
氯化铬酰(CrO3Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题。
(1)写出铬原子的基态电子排布式:____________________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有________(填元素符号)。
(2)CrO2Cl2常温下为深红色液体,能与CCl4,CS2等互溶,据此可判断CrO2Cl2是________分子(填“极性”或“非极性”)。
(3)在①苯、②CH3OH,③HCHO,④CS2,⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________(填序号),CS2分子的空间构型是________,易溶于水的有________(填序号),理由是:_______________________________。
-
氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题。
(1)写出铬原子的基态电子排布式: ______________________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有________(填元素符号)。
(2)CrO2Cl2常温下为深红色液体,能与CCl4,CS2等互溶,据此可判断CrO2Cl2是________分子(填“极性”或“非极性”)。
(3)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________(填序号),CS2分子的空间构型是________
-
(5分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的基态电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图示。该合金的化学式为_______________;

(4)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。该结构中,氮原子的杂化轨道类型为_______________。氧原子的杂化轨道类型为_______________。
-
氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物) 做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是_______。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N 原子的杂化形式为____。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____。原因是____。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______。
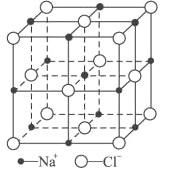
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
 。
。
-
金属镍在电池、合金、催化剂等方面应用广泛.
(1)Ni是元素周期表中第28号元素,基态Ni原子核外电子排布式为______.第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是______(填元素符号).
(2)金属镍可以和CO形成配位化合物Ni(CO)n.
①CO与N2结构相似,CO分子内σ键与π键个数之比为______.
②已知配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=______.
(3)很多不饱和有机物在Ni的催化下可以与H2发生加成反应.如CH2=CH2、CH≡CH、苯、甲醛(H2C=O)等.
①有关苯分子中的化学键描述不正确的是______
A.碳原子的三个sp2杂化轨道与其他原子形成的三个σ键
B.每个碳原子的未参加杂化的2p轨道用来形成大π键
C.每个碳原子的sp2杂化轨道中的一个用来形成大π键
D.苯分子中六个碳碳键完全相同,键角均为120°
②甲醛(H2C=O)分子内碳原子的杂化方式为______,其分子构型为______.
③甲醛(H2C=O)在Ni的催化作用下加氢可得甲醇(CH3OH).甲醇分子内碳原子的杂化方式为______,甲醇分子内的O-C-H键角______(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角.
-
氮的化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列相关问题:
(1)基态氮原子的电子排布式为____,碳、氮、氧元素的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)NH4Cl中阳离子的空间构型为______,与NH4+互为等电子体的一种非极性分子的化学式为________。
(3)NH4Cl受热易分解产生氨气,向CuSO4溶液中通入氨气至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,该溶液中存在的配离子的结构式为_______(配位键用→表示)。
(4)GaAs与GaN均为原子晶体,GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为_________。
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_______。已知GaAs的密度为ρ g/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,阿伏伽德罗常数的值为NA,则GaAs晶胞中Ga之间的最短距离为_______pm(写出表达式)。

-
钴(Co)是人体必需的微量元素。含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用。请回答下列问题:
(1)Co基态原子的外围电子排布式为 ;
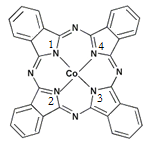
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。
①酞菁钴中三种非金属原子的电负性由大到小的顺序为 ;
(用相应的元素符号作答);碳原子的杂化轨道类型为 ;
②与钴离子通过配位键结合的氮原子的编号是 ;
(3)Co的一种氧化物的晶胞如下图所示,在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是 。
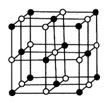
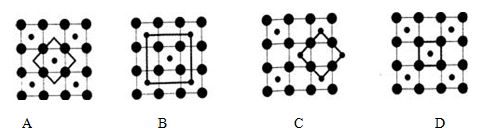




 。
。


