-
(8分) 实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) △ MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是________mol,转移电子的物质的量是________mol。
(2)在制取Cl2时为防止其污染环境用NaOH溶液吸收尾气.写出其离子方程式___________.
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)________。
-
(14分)实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,氧化剂是 ,如有1 mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol;
(2)将制得氯气通入冷的消石灰[Ca(OH)2 ]中即可制得漂白粉,其反应的化学方程式是 ;在某温度下,将Cl2通入浓NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,此反应的化学方程式是 ;
(3)进行有关氯气的性质实验时,需2.24 L的氯气(标准状况),理论上需要MnO2固体的质量为
g。(浓盐酸足量)
(4)前段时间,报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示) 。
-
(6分)实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) △ MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol。
(2)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示) 。
-
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓)  MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol。
(2)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 。
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示) 。
-
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓)  MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
-
实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O。
MnCl2 + Cl2↑ + 2H2O。
取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求:
(1)生成的还原产物的物质的量是多少?
(2)(忽略Cl2的溶解)产生的氯气在标准状况下的体积为多少?
(3)反应中被氧化的HCl的物质的量是多少?
-
实验室常见浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O.8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气.计算:
(1)被氧化的HCl有______mol,转移的电子数为______个.
(2)若向反应后剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度?(要有具体的计算过程)
-
(10分)(1)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
①写出该反应的离子反应方程式_________________________,②反应中被氧化的HCl的物质的量为 ________ 。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________
。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________ 。
。
(2)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入 溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
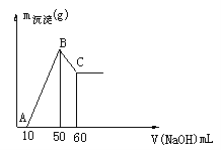
①合金中镁的质量 g。
②盐酸的物质的量浓度  。
。
-
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为: MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O。取足量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为11.2L。请计算:
MnCl2+Cl2↑+2H2O。取足量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为11.2L。请计算:
(1)参加反应的二氧化锰的质量为多少克?____________
(2)反应中被氧化的HCl的物质的量为多少摩尔?____________
-
(8分)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
(1)写出该反应的离子反应方程式_____________________________________。
(2)参加反应的二氧化锰的质量为____________。
(3)反应中被氧化的HCl的物质的量为 ____________。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g·cm-3,为使用方便,请计算出该浓盐酸
的物质的量浓度______________。
Cl2↑+MnCl2+2H2O,HCl 所起的作用有:_____________________。
