-
蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ·mol-1
②CH4(g)+ O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3=+165.0kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为__。
(2)从原料、能源利用的角度,分析以上三个反应,作为合成甲醇更适宜的是反应__(填序号)。
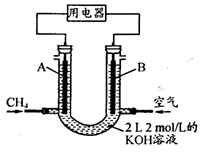
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
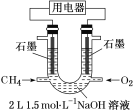
①0<V≤33.6L时,负极电极反应式为__。
②33.6L<V≤67.2L时,电池总反应方程式为__。
③V=44.8L时,溶液中离子浓度大小关系为__。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ |
| N2 | H2 | NH3 |
| Ⅰ | 1 | 4 | 0 | t1 | 放出热量:36.88 |
| Ⅱ | 2 | 8 | 0 | t2 | 放出热量:Q |
①容器Ⅰ中,0~t1时间的平均反应速率v(H2)=__。
②下列叙述正确的是__(填字母)。
a.平衡时,两容器中H2的体积分数相等
b.容器Ⅱ中反应达到平衡状态时,Q>73.76
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:Ⅰ<Ⅱ
e.两容器达到平衡时所用时间:t1>t2
(5)如图是在反应器中将N2和H2按物质的量之比为1∶3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。
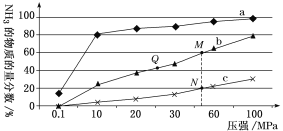
①曲线a对应的温度是__。
②图中M、N、Q点平衡常数K的大小关系是__。
③M点对应的H2转化率是__。
-
蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料、能源利用的角度,分析作为合成甲醇更适宜的是反应 。(填序号)
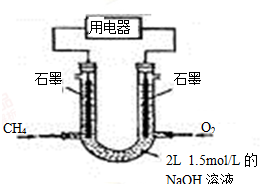
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
①0<V≤33.6L时,负极电极反应为 。
②33.6L<V≤67.2L时,电池总反应方程式为 。
③V=44.8L时,溶液中离子浓度大小关系为 。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ |
| N2 | H2 | NH3 |
| ① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
| ② | 2 | 8 | 0 | t2 min | 放出热量:Q |
| | | | | |
下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(5)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
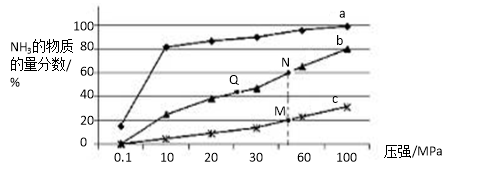
①上图中M、N、Q点平衡常数K的大小关系是 。
②M点对应的H2转化率是 。
-
蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料、能源利用的角度,分析四个反应,作为合成甲醇更适宜的是反应 。(填序号)
(3)也可将CH4设计成燃料电池,来解决能源问题,如下图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
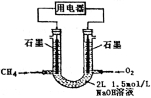
①0<V≤33.6L时,负极电极反应为 。
②33.6L<V≤67.2L时,电池总反应方程式为 。
③V=44.8L时,溶液中离子浓度大小关系为 。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。
某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ |
| N2 | H2 | NH3 |
| ① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
| ② | 2 | 8 | 0 | t2 min | 放出热量:Q |
| | | | | |
①容器①中,0-t1时间的平均反应速率为υ(H 2)= 。
2)= 。
②下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(5)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。
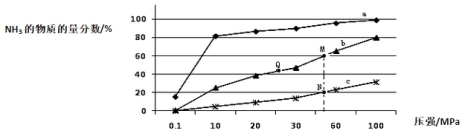
①曲线a对应的温度是 。
②上图中M、N、Q点平衡常数K的大小关系是 。
③M点对应的H2转化率是 。
-
蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)也可将CH4设计成燃料电池,来解决能源问题,如下图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
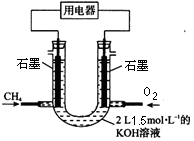
①0<V≤33.6L时,负极电极反应为 。
②V=44.8L时,溶液中离子浓度大小关系为 。
(3)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。
某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系 能量的变化/kJ |
| N2 | H2 | NH3 |
| ① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
| ② | 2 | 8 | 0 | t2 min | 放出热量:Q |
| | | | | |
①容器①中,0-t1时间的平均反应速率为υ(H2)= 。
②下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(4)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。
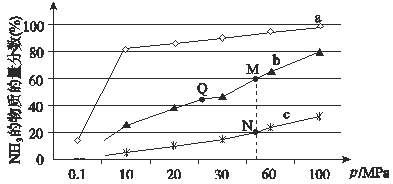
①曲线a对应的温度是 。
②上图中M、N、Q点平衡常数K的大小关系是 。
③M点对应的H2转化率是 。
-
海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:① CH4(g)+H2O (g)=CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为________。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是________。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是: [Cu(NH3)2]Ac + CO + NH3  [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是________。
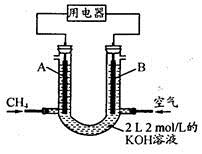
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。0<V≤44.8 L时,电池总反应方程式为________。
② 44.8 L<V≤89.6 L时,负极电极反应为________。
③ V=67.2 L时,溶液中离子浓度大小关系为________。
-
海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是 。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac + CO + NH3  [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
① 0<V≤44.8 L时,电池总反应方程式为 。
② 44.8 L<V≤89.6 L时,负极电极反应为 。
③ V=67.2 L时,溶液中离子浓度大小关系为 。
-
化学在能源开发与利用中起着十分重要的作用.
(1)蕴藏在海底的“可燃冰”是高压下形成的外观酷似冰的甲烷水合物.我国南海海底有丰富的“可燃冰”资源.取365g分子式为CH4•9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成CO2和H2O(l),可放出1780.6kJ的热量,则甲烷燃烧的热化学方程式为________.
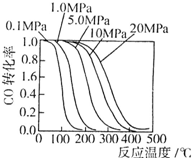
(2)甲醇是重要的基础化工原料,又是一种新型的燃料,制取甲醇的传统方法是采用CuO-ZnO/γ-Al2O3为催化剂,合成反应为:CO+2H2 CH3OH.生产中一些工艺参数如图所示.该反应为________(填“吸热”或“放热”)反应.说明你作出判断的依据________.
CH3OH.生产中一些工艺参数如图所示.该反应为________(填“吸热”或“放热”)反应.说明你作出判断的依据________.
最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的正极反应式为________.电池工作时,固体电解质里的O2-向________极推动.
-
(14分)化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体.被称之为“未来能源”。在25℃、101 kPa下,1g甲烷完全燃烧生成和液态水时放热55.6 kJ。甲烷燃烧的热化学方程式为 ______:相同条件下,356 g可燃冰(分子式为CH4·9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_______kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制各二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)═CH3OH(g) △H1=-90.1kJ•mol-1
(Ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g) △H2=-49.0kJ•mol-1
水煤气变换反应:(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2 (g) △H3=-41.1kJ•mol-1
二甲醚合成反应:(Ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ•mol-1
①分析二甲醚合成反应(iv)对于CO转化率的影响___________________________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:__________________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响_________________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为______________________,一个二甲醚分子经过电化学氧化,可以产生________电子的电量。
-
化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体。2017年我国在南海北部进行的可燃冰采取试验获得成功,标志着我国成为第一个实现在海域可燃冰试开采中获得连续稳定燃气的国家。已知:25℃、101 kPa下,1 g甲烷完全燃烧生成CO2和液态水时放热55.6kJ。甲烷燃烧的热化学方程式为_____________。相同条件下,356 g可燃冰(分子式为CH4·9H2O,Mr= 178 )释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_____kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+ 2H2(g)  CH3OH(g) △H1=-90.1 kJ/ mol
CH3OH(g) △H1=-90.1 kJ/ mol
(ii)CO2(g) + 3H2(g)  CH3OH(g)+ H2O(g) △H2=-49.0kJ/ mol
CH3OH(g)+ H2O(g) △H2=-49.0kJ/ mol
水煤气变换反应: (iii) CO(g)+ H2O(g)  CO2(g) + H2(g) △H3=-41.1kJ/mol
CO2(g) + H2(g) △H3=-41.1kJ/mol
二甲醚合成反应:(iv) 2CH3OH(g)  CH3OCH3(g) + H2O(g) △H4= -24.5kJ/ mol
CH3OCH3(g) + H2O(g) △H4= -24.5kJ/ mol
①分析二甲醚合成反应(iv)对于CO转化率的影响____________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:______________。 根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响__________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为____ ,一个二甲醚分子经过电化学氧化,可以产生______个电子的电量。
-
当前环境问题是一个全球重视的问题,引起环境问题的气体常见的有温室气体CO2、污染性气体NOx、SOx等。如果对这些气体加以利用就可以成为重要的能源,既解决了对环境的污染,又解决了部分能源危机问题。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。CO2与H2反应制备CH3OH和H2O的化学方程式为 。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH2=+ 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式 。
(3)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-889.6 kJ·mol-1 ①
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是 。

2)= 。









