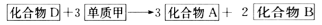-
碳和氧元素及其化合物与人类的生产、生活密切相关。
I.氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备气态氯胺(NH2Cl),己知部分化学键的键能:
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能/KJ•mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
则上述反应的热化学方程式为:__________________。
(2)氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为_____________。
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
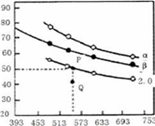
(3)在三个容积均为1L的密闭容器中以不同的氢碳比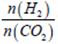 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
①反应的△H______0,氢碳比α____β,Q点v(正)_____v(逆)(填“>”或“<”、“=”)
②若起始时,CO2的浓度分别为0.5mol/L,則P点对应温度度的平衡常数的值为________。
(4)己知:碳酸 H2CO3: K1=4.3×10-7、K2=5.6×10-11;
草酸 H2C2O4: K1=6.0×10-2、K2=6.0×10-5
① 下列微粒可以大量共存的是_______(填字母)。
a.CO32-、HC2O4- b.H2CO3、C2O42- c. C2O42-、HCO3- d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是_________。
-
碳和氯元素及其化合物与人类的生产、生活密切相关。
I、氯的化合物合成、转化一直是科学研究的热点。
①一定条件下,氯气与氨气反应可以制备氯胺(NH2C1),己知部分化学键的键能:

则上述反应的热化学方程式为:____________。
②氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为______________:
Ⅱ、碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。

(1)在三个容积均为1L的密闭容器中以不同的氢碳比 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
①反应的△H_____0,氢碳比α____β,Q点v(正)_____v(逆)(填“大于”或“小于”)
②若起始时,CO2的浓度为0.5mol·L-1,氢气的浓度0.1mol/L;则P点对应温度的平衡常数的值为_______。
(2)已知:碳酸H2CO3,K1=4.3×10-7、K2=5.6×10-11、草酸H2C2O4,K1=6.0×10-2、K2=6.0×10-5
①下列微粒可以大量共存的是_______(填字母)。
a.CO32-、HC2O4- b.H2CO3、C2O42- c. C2O42-、HCO3- d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是_________。
③通过技术判断中和反应2Fe(OH)3(s)+3H2C2O4 2Fe3++6H2O+3C2O42-在常温下能否发生反应________。(已知:Ksp[Fe(OH)3]=1.0×10-39;66=4.67×104)
2Fe3++6H2O+3C2O42-在常温下能否发生反应________。(已知:Ksp[Fe(OH)3]=1.0×10-39;66=4.67×104)
-
碳和氯元素及其化合物与人类的生产、生活密切相关。
I、氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备氯胺(NH2Cl)气体,己知部分化学键的键能:
| 化学键 | N—H | CI—Cl | N—Cl | H—Cl |
| 键能/ kJ•mol-1 | 391.3 | 243.0 | 191.0 | 431.8 |
则上述反应的热化学方程式为:__________________。
(2)氯胺(g)是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为______________________。
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
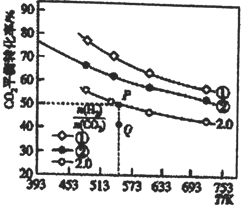
(1)在三个容积均为1L的密闭容器中以不同的氢碳比 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。
请回答下列问题:
①氢碳比①________②,Q点V(正) ___v(逆),该反应的ΔH ________0,(填“大于”或“小于”)
②若起始时,CO2、H2 的浓度分别为0.5mol·L-1、l mol·L-1,则P点对应温度的平衡常数的值为_____。P点对应的平衡常数__________Q点对应的平衡常数(填“>”、“<”或“=”)
(2)已知:碳酸H2CO3,K1=4.3×10-7、K2=5.6×10-11
草酸H2C2O4,K1=6.0×10-2、K2=6.0×10-5
①下列微粒可以大量共存的是___________(填字母)。
a.H2CO3、C2O42- b.CO32-、HC2O4- c. C2O42-、HCO3- d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外) 浓度由大到小的顺序是_________________________________。
【答案】 NH3+Cl2=NH2Cl+HCl ΔH=+11.5kJ/mol  > > 小于 29 = a c c(H+)>c(HC2O4-)>c(C2O4-)>c(HCO3-)>c(CO32-)
> > 小于 29 = a c c(H+)>c(HC2O4-)>c(C2O4-)>c(HCO3-)>c(CO32-)
【解析】试题分析:I、(1)根据反应物的总键能—生成物的总键能=焓变,书写热化学方程式;(2)氯胺水解生成氨水和强氧化性的次氯酸;II.(1)①氢气的含量越大,CO2的平衡转化率越大;Q点要达到平衡,CO2的转化率增大,反应正向进行;随温度升高,CO2的平衡转化率减小,平衡逆向移动;②利用“三段式”计算平衡常数;P点、Q点温度相同,对应的平衡常数相同;(2)①根据强酸制取弱酸的规律分析;②根据电离平衡常数分析,
解析:I、(1)NH3+Cl2=NH2Cl+HCl的焓变= kJ/mol,所以热化学方程式是NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g) ΔH=+11.5kJ/mol;(2)氯胺水解生成氨水和强氧化性的次氯酸,水解方程式是
kJ/mol,所以热化学方程式是NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g) ΔH=+11.5kJ/mol;(2)氯胺水解生成氨水和强氧化性的次氯酸,水解方程式是 ;II. (1)①氢气的含量越大,CO2的平衡转化率越大,所以氢碳比①>②;Q点要达到平衡,CO2的转化率增大,反应正向进行,V(正) >v(逆);随温度升高,CO2的平衡转化率减小,平衡逆向移动,ΔH <0;
;II. (1)①氢气的含量越大,CO2的平衡转化率越大,所以氢碳比①>②;Q点要达到平衡,CO2的转化率增大,反应正向进行,V(正) >v(逆);随温度升高,CO2的平衡转化率减小,平衡逆向移动,ΔH <0;
②

 ;P点、Q点温度相同,平衡常数相同;所以P点对应的平衡常数=Q点对应的平衡常数;(2)①a.草酸的K2大于碳酸的K1,所以H2CO3、C2O42-可以共存;b. 草酸的K2大于碳酸的K2,所以CO32-、HC2O4-不能共存;c. 草酸的K2大于碳酸的K2,所以 C2O42-、HCO3-能共存;d. 草酸的K1大于碳酸的K1,所以H2C2O4、HCO3-不能共存;②草酸的K1>K2大于碳酸的K1>K2,所以等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子 浓度由大到小的顺序是c(H+)>c(HC2O4-)>c(C2O4-)>c(HCO3-)>c(CO32-)。
;P点、Q点温度相同,平衡常数相同;所以P点对应的平衡常数=Q点对应的平衡常数;(2)①a.草酸的K2大于碳酸的K1,所以H2CO3、C2O42-可以共存;b. 草酸的K2大于碳酸的K2,所以CO32-、HC2O4-不能共存;c. 草酸的K2大于碳酸的K2,所以 C2O42-、HCO3-能共存;d. 草酸的K1大于碳酸的K1,所以H2C2O4、HCO3-不能共存;②草酸的K1>K2大于碳酸的K1>K2,所以等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子 浓度由大到小的顺序是c(H+)>c(HC2O4-)>c(C2O4-)>c(HCO3-)>c(CO32-)。
点睛:弱酸的电离平衡常数越小,说明酸性越弱;酸性越弱同浓度的酸溶液的PH越大、酸根离子的浓度越小;电离平衡常数大的酸能制取电离平衡常数小的酸。
【题型】综合题
【结束】
11
向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式__________,____________。
(2)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是_________(填元素符号),第一电离能最大的是_________(填元素符号)。该晶体中的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(4)氨的沸点_________(填“高于”或“低于”)膦(PH2),原因是_____________。
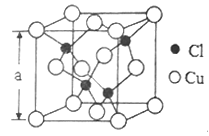
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。
-
CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及二甲醚具备相对成熟的技术。工业生产中,有以下相关反应(热效应都是在25 ℃,1.01×105Pa下测定):
①CO2(g) + 3H2(g)  CH3OH(l) + H2O(l) ΔH =-49.01
CH3OH(l) + H2O(l) ΔH =-49.01  kJ·mol-1
kJ·mol-1
②2CH3OH(l)  CH3OCH3(g) + H2O(l) ΔH =-24.52 kJ·mol-1
CH3OCH3(g) + H2O(l) ΔH =-24.52 kJ·mol-1
③CO(g) + H2O(l)  CO2(g) + H2(g) ΔH = -41.17 kJ·mo
CO2(g) + H2(g) ΔH = -41.17 kJ·mo l-1
l-1
(1)工业上用CO2和H2合成二甲醚的热化学方程式为_____________________________________。
(2)反应①的平衡常数表达式K=____________。
(3)在一常温恒容的密闭容器中,放入一定量的甲醇发生如②式化学反应并建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据的是__________(填字母)。
A.容器内气体相对分子质量保持不变
B. 容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍
D.甲醇和二甲醚物质的量相等
(4)在三个体积相同的密闭容器中加入相同物质的量的CO和H2O,在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如下图:
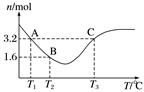
Ⅰ.A、C两点的速率大小v(A)________(填“大于”“小于”“等于”或“无法判断”)v(C)。
Ⅱ.请解释曲线中CO的物质的量先减小后增大的原因______________________________________________。
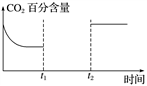
(5)一定量的CO2和H2在一密闭容器中发生反应①,下图是容器内CO2的百分含量随着外界条件改变的变化曲线图,请补充完整(t1时刻升温;t2时刻添加催化剂)。__________________
-
Ⅰ.CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及二甲醚 (CH3OCH3)具备相对成熟的技术。工业生产中,有以下相关反应
①CO2(g) + 3H2(g)  CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
②2 CH3OH(l)  CH3OCH3(g) + H2O(l) △H < 0
CH3OCH3(g) + H2O(l) △H < 0
③CO(g) + H2O(l)  CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
(1)在一常温恒容的密闭容器中,放入一定量的甲醇如②式建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据为________。
A.容器内气体相对分子质量保持不变
B.容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍;
D.甲醇和二甲醚物质的量相等
(2)在三个体积相同的密闭容器A,B,C中加入相同物质的量的CO和H2O在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如下图:

① A、B两点的速率大小v(A)___v(B)(填“大于”、“小于”、“等于”、“无法判断”)
② 请解释曲线中CO的物质的量先减小后增大的原因________________________。
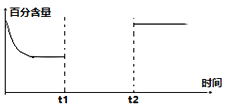
(3)一定量的CO2和H2在一密闭容器中发生反应①,下左图是容器内CO2的百分含量随着外界条件改变的变化曲线图,请补充完整。(t1时刻升温;t2时刻加催化剂)______

Ⅱ.SO2的尾气处理通常用电化学处理法
(4)①如上右图所示,Pt(Ⅱ)电极的反应式为__________________;
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加_____mol离子。
-
A、B、C是与生命运动密切相关的三种化合物,它们所含的元素不超过三种,并有下列转化关系:
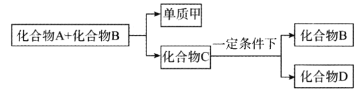
其中化合物D也是日常生活中常见的化合物,在一定条件下可与单质甲进一步发生如下变化:
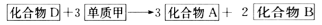
回答下列有关问题:
(1)在A、B、C、D四种化合物中,所含元素相同的是_________、_________(填物质名称)。
(2)常温下,A和B是通过什么途径转化为C的?________________。
(3)目前,化合物B在自然界中的含量呈上升趋势,对环境产生了不良的影响,发生这种变化的主要原因是_________________。
(4)化合物D另有一种同分异构体,这种同分异构体的结构简式是_________________。
-
A、B、C是与生命运动密切相关的三种化合物,它们所含的元素不超过三种,并有下列转化关系:

其中化合物D也是日常生活中常见的化合物,在一定条件下可与单质甲进一步发生如下变化:

回答下列有关问题:
(1)在A、B、C、D四种化合物中,所含元素相同的是_________、_________(填物质名称)。
(2)常温下,A和B是通过什么途径转化为C的?________________。
(3)目前,化合物B在自然界中的含量呈上升趋势,对环境产生了不良的影响,发生这种变化的主要原因是_________________。
(4)化合物D另有一种同分异构体,这种同分异构体的结构简式是_________________。
-
(8分)A、B、C是大家熟悉的与生命运动密切相关的三种化合物,它们所含元素不超过三种;并有如下图所示的转化关系。

其中D是日常生活中常见的有机化合物,在一定条件下,可与单质甲进一步发生如下变化:D+3甲→3A+2B。试回答以下问题:
(1)在A、B、C、D四种化合物中,所含元素种类完全相同的是__________(写字母代码和物质名称)。
(2)在常温下,A和B通过__________作用转化为C。
(3)目前,化合物B在自然界中的含量呈上升趋势,对于环境产生了不良影响,发生这种变化的主要原因是______________________________。
-
化学与社会、生产、生活密切相关。下列说法正确的是
A.碳纤维是一种新开发的材料,它属于合成有机高分子化合物
B.对“地沟油”进行分馏可得到汽油
C.漂白粉长期暴露在空气中最后会变质失效
D.氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用
-
化学与人类生产、生活、社会可持续发展密切相关,下列说法不正确的是
A.我们熟悉的塑料、合成橡胶和合成纤维这三大合成材料,都主要是以石油、煤和天然气为原料生产的
B.碱性氧化物由金属元素和氧元素组成,MgO、K2O、Na2O2、Mn2O7、Fe2O3中有四种为碱性氧化物
C.可用食醋、碘化钾淀粉试纸检验食盐中存在IO3-
D.干电池即使不用,放置过久,也可能漏液失效,其原因是电解质溶液NH4Cl显酸性和外壳锌反应
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。

> > 小于 29 = a c c(H+)>c(HC2O4-)>c(C2O4-)>c(HCO3-)>c(CO32-)
kJ/mol,所以热化学方程式是NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g) ΔH=+11.5kJ/mol;(2)氯胺水解生成氨水和强氧化性的次氯酸,水解方程式是
;II. (1)①氢气的含量越大,CO2的平衡转化率越大,所以氢碳比①>②;Q点要达到平衡,CO2的转化率增大,反应正向进行,V(正) >v(逆);随温度升高,CO2的平衡转化率减小,平衡逆向移动,ΔH <0;

;P点、Q点温度相同,平衡常数相同;所以P点对应的平衡常数=Q点对应的平衡常数;(2)①a.草酸的K2大于碳酸的K1,所以H2CO3、C2O42-可以共存;b. 草酸的K2大于碳酸的K2,所以CO32-、HC2O4-不能共存;c. 草酸的K2大于碳酸的K2,所以 C2O42-、HCO3-能共存;d. 草酸的K1大于碳酸的K1,所以H2C2O4、HCO3-不能共存;②草酸的K1>K2大于碳酸的K1>K2,所以等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子 浓度由大到小的顺序是c(H+)>c(HC2O4-)>c(C2O4-)>c(HCO3-)>c(CO32-)。

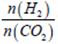 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)