-
黄铁矿主要成分是 FeS2。某硫酸厂在进行黄铁矿成分测定时,取 0.1000 g 样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为 0.02000 mol·L-1的 K2Cr2O7标准溶液滴定至终点,重复实验,平均消耗K2Cr2O7标准溶液 20.00mL。
(1)硫酸工业中煅烧黄铁矿的设备名称_____。
(2)该样品FeS2的质量分数为_____;
高三化学计算题中等难度题查看答案及解析
-
黄铁矿主要成分是 FeS2。某硫酸厂在进行黄铁矿成分测定时,取 0.1000 g 样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为 0.02000 mol·L-1的 K2Cr2O7标准溶液滴定至终点,重复实验,平均消耗K2Cr2O7标准溶液 20.00mL。
(1)硫酸工业中煅烧黄铁矿的设备名称_____。
(2)该样品FeS2的质量分数为_____;
高三化学计算题中等难度题查看答案及解析
-
黄铁矿主要成分是 FeS2。某硫酸厂在进行黄铁矿成分测定时,取 0.1000 g 样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为 0.02000 mol·L-1的 K2Cr2O7标准溶液滴定至终点,重复实验,平均消耗K2Cr2O7标准溶液 20.00mL。
(1)硫酸工业中煅烧黄铁矿的设备名称_____。
(2)该样品FeS2的质量分数为_____;
高三化学计算题中等难度题查看答案及解析
-
(8分)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:SO2+2Fe3++2H2O═
+2Fe2++4H+
Cr2
+6Fe2++14H+═2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)________。
(2)若灼烧6gFeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式 ________。
(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为 ________L,制得98%在硫酸质量为 ________t,SO2全部转化为H2SO4时放出的热量是 ________kJ。
高三化学计算题简单题查看答案及解析
-
黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。(M(FeS2)=120g/mol)
已知:SO2 + Fe3+ + H2O ——SO42- +Fe2+ + H+
Cr2O7 2-+ 6 Fe2+ + 14 H+ ==== 2 Cr3+ + 6 Fe3+ + 7 H2O
(1)将此方程式配平:_______________________________________________________________H+
(2)样品中FeS2的质量分数是(假设杂质不参加反应)________________。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸 质量为__________ t 。
高三化学简答题简单题查看答案及解析
-
黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O =SO42-+ 2Fe2++ 4H+
Cr2O72-+ 6 Fe2+ + 14 H+=2 Cr3+ + 6 Fe3+ + 7 H2O
⑴①黄铁矿煅烧的化学方程式为: 。
②样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式: ___________________________________________。
⑶煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_____________L,制得98%的硫酸质量为_________ t ,SO2全部转化为H2SO4时放出的热量是________kJ。
(4)硫酸的用途非常广泛,请写出用之制取“普钙”的化学方程式并用最简洁的语言解释为什么这种化肥不能与草木灰混合施用: ;
、 。
高三化学填空题中等难度题查看答案及解析
-
黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O == SO2- + 2Fe2+ + 4H+
Cr2O
+ 6 Fe2+ + 14 H+ == 2 Cr3+ + 6 Fe3+ + 7 H2O
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:____________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
高三化学计算题简单题查看答案及解析
-
黄铁矿主要成分是FeS2.某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量‘Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.
已知:SO2+2Fe3++2H2O═SO2-+2Fe2++4H+
Cr2O+6Fe2++14H+═2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)________.
(2)若灼烧6g FeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式:________.
(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为________L,制得98%的硫酸质量为________ t,SO2全部转化为H2SO4时放出的热量是________ kJ.高三化学填空题中等难度题查看答案及解析
-
黄铁矿主要成分是FeS2.某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)接触室中发生反应的化学方程式是______高三化学解答题中等难度题查看答案及解析
-
某硫酸厂进行硫铁矿(主要成分是FeS2)含量的测定.取样品0.1000g在空气中充分灼烧,将生成的SO2气体与足量的Fe2(SO4)3溶液反应,反应后的溶液用浓度为0.02000mol•L-1
的KMnO4溶液滴定至终点,消耗KMnO4溶液30.00mL.已知:
SO2+2Fe3++2H2O=SO2-4+2Fe2++4H+;5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O
(1)滴定前______(填“需要”或“不需要”)滴加指示剂.滴定至终点的判断方法是______.
(2)样品中FeS2的质量分数是______(假定杂质不参加反应).
(3)若灼烧6g纯净FeS2产生的SO2全部被氧化为SO3气体,再将产生的SO3气体全部与水化合生成硫酸溶液时,放出13.03kJ热量,写出SO3气体转化为H2SO4溶液的热化学方程式:______.
(4)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
①用CH4催化还原NOx为N2可以消除氮氧化物的污染.试写出总反应的化学方程式:______.
②新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下它能使工业废气中的氮的氧化物、SO2分解,减小工业废气对环境的影响,它可由铁酸锌(ZnFe2O4)经高温还原制得.转化流程如下图所示: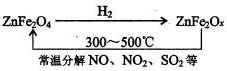
若2mol ZnFe2Ox与SO2反应可生成0.75mol S,则x=______.高三化学解答题中等难度题查看答案及解析